|
|
微流控资讯 | 一种基于数字微流体平台的全自动识别多种呼吸道病原体的综合征诊断分析方法发表时间:2024-01-08 10:59 大家好!今天为大家分享一篇2023年发表在Lab-On-Chip上的文章,题目为“A syndromic diagnostic assay on a macrochannel to-digital microfluidic platform for automatic identification of multiple respiratory pathogens”。作者在这项研究中,在单个宏通道到数字微流控芯片上开发了一种低成本的“样本输入-结果输出”系统,集核酸提取、纯化和扩增于一体。并且芯片的制造已准备好进行规模化制造,并且由于它们是使用印刷电路板 (PCB) 和预制块组装而成,因此可一次性使用。本文的通讯作者为暨南大学智能系统科学与工程学院陈东教授。 研究背景 全球新冠肺炎大流行改变了人们的生活和诊断格局,由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)引起的全球大流行显著改变了数十亿人的日常生活,并深刻影响了全球经济、政治和社会领域的发展。核酸扩增试验(NAT)作为一种检测特定的脱氧核糖核酸(DNA)或核糖核酸(RNA)序列的技术,长期以来一直应用于分子研究、基因检测、法医学、农业和临床医学等许多领域,也成为SARS-CoV-2检测的标准之一,NAT可在症状出现时及时、方便地从鼻咽、口咽拭子等标本中检测到病原体。 然而,目前传统检测方式仍然存在一些缺点:它需要一个集中实验室的复杂设备和高技能的技术人员来操作它。同时,这种场外检测也带来了许多关于及时性和安全性的不确定性。因此,基于NAT的全自动和便携式即时检测(POCT)设备在各大分布诊所、偏远地区和病原体原始发展区域分散使用是十分必要的。针对此,暨南大学陈冬联合澳门科技大学 Pui-In Mak团队共同提出了一种基于数字微流体平台(DMF)的一体化的NAT系统(图1),名为Virus Hunter 2.0(VH 2.0)。旨在从DMF的设计和商业化角度提供其诊断应用。 图文导读 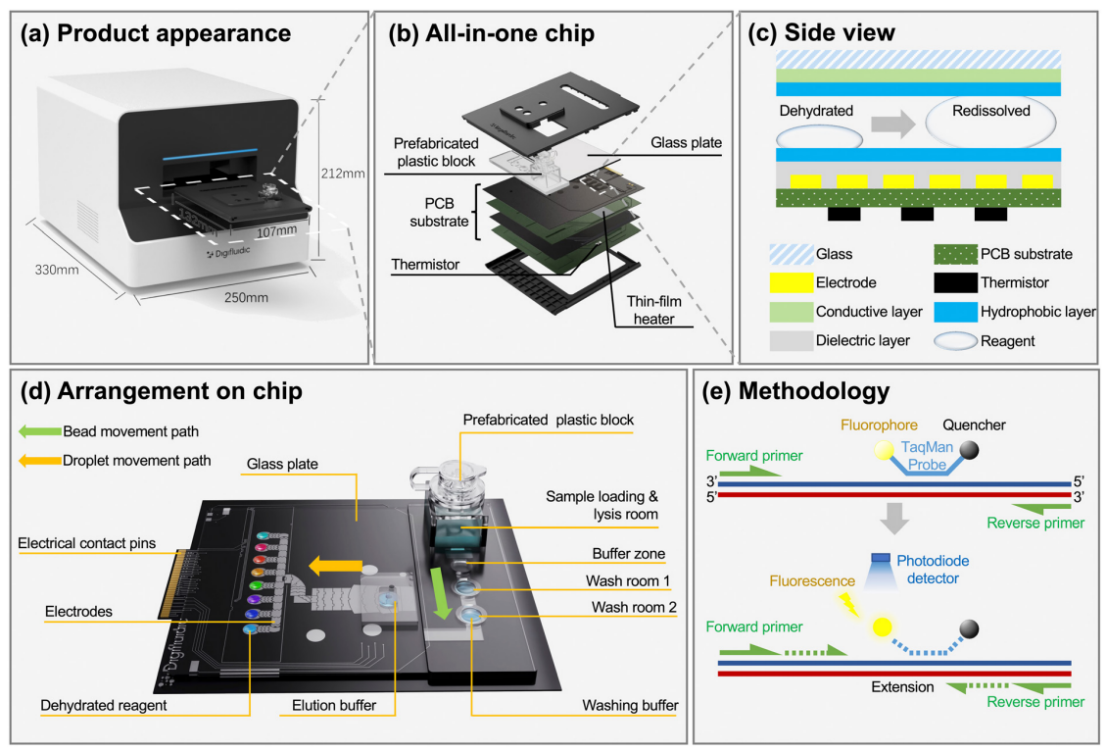 图1: Virus Hunter2.0(VH 2.0)示意图 Virus Hunter 2.0(VH 2.0)由四部分组成:(1)磁性模块,利用电动磁棒来收集和吸引磁珠来实现洗涤/洗脱功能。(2)温控系统,其中加热模块集成于芯片上,设备上耦合制冷模块,仅采用比热容大的金属块便可实现最大5℃/s的冷却速率。(3)光学检测系统,采用led、滤光片、透镜、分束器和光电二极管等装置进行荧光检测。(4)DMF控制系统,用于控制电压改变液滴/电极间的润湿性以实现对不同尺寸的不同液滴的精确控制。 VH 2.0所用的芯片尺寸为132 mm×107 mm,具有检测病原体基因的特异性功能。除了常规功能外,在微型芯片上还实现了两项创新,即(1)将基于通道的微流体与用于RT-qPCR制备的数字微流体相结合和反应;(2)印刷电路板(PCB)中电阻式薄膜加热器和热传感器的集成。基于通道的微流体技术的引入允许在核酸提取序列中处理大量的缓冲液和磁珠。用聚碳酸酯(PC)预制了一个取样管、裂解室和两个洗涤室,并将液体试剂封装在一个特定的腔室中(图1 d ) 。 在数字微流控区域,采用ITO顶部玻璃与PCB平行产生0.6 mm间隙一致,中间修饰介电和导电层。通过DMF控制系统使液滴在腔室中平稳移动。qPCR的试剂(引物、探针、dNTP、酶)在特定反应室脱水预储存。 VH 2.0用户只需三个简单步骤:(1)添加样品-用咽拭子摇管10-20次,然后将样品加入500μL(最大加载1000μL),盖盖;(2)插入芯片-将微芯片插入设备并启动分析软件;(3)读取结果,分析完成后获得结果。绝大部分工作在芯片上全自动完成,实现“sample-in-to-answer-out”。包括:(1)注入500 μL原样;(2)注入样品将20 μL、5 μL蛋白酶K和磁珠推入裂解室;(3)样品与1000 μL裂解缓冲液混合,60°C孵育2 min;(4)释放的RNA与磁珠结合;(5)芯片下的磁体向上移动收集磁珠;(6)磁体进入洗涤室1,与90 μL洗涤缓冲液1混合;(7)结合RNA与磁珠一起洗涤;(8)珠移至2洗涤室,与90 μL洗涤缓冲液2混合;(9)珠再次进行洗涤程序,(10)珠移至隔壁房间;(11)用60 μL洗脱缓冲液洗脱;(12)丢弃;(13)纯RNA移到分离区,(14)每滴5.55 μL;(15)分配的液滴移到PCR区域,用干燥的PCR预混物重新溶解;在这些单元中进行qPCR,并将荧光信号发送到VH 2.0分析仪。 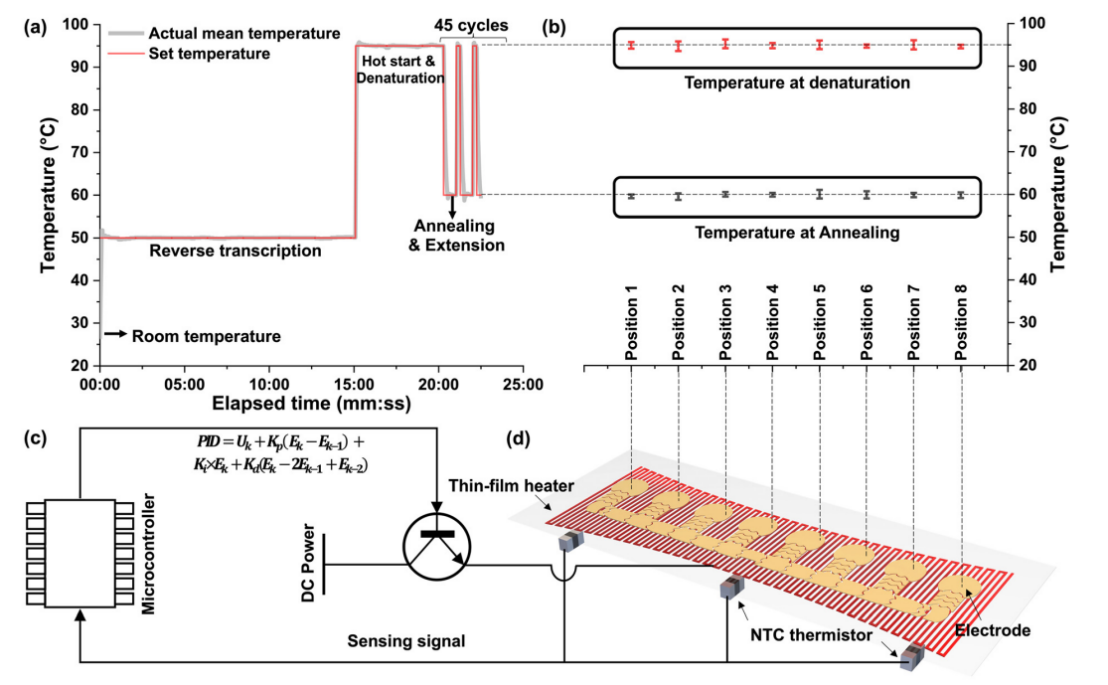 图2 (a) RT-qPCR过程中芯片上反应点的设定温度和实际温度。 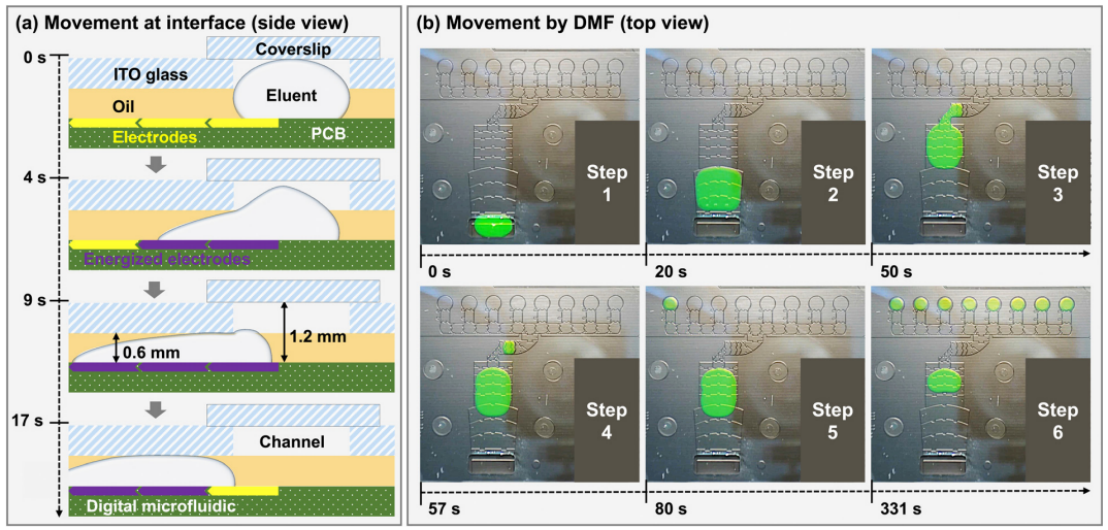 图3 电极驱动液滴从宏观通道到数字微流控室的示意图:(a)侧视图;(b)俯视图。 通过优化电阻器在PCB上的模式和实现PID控制(图2),从95°C下降到60°C约需要13秒,上升到95°C。升温期间温度稳定性<±1.27°C,恒温温度稳定性<±为0.5°C。为了使大液滴从界面中逸出,通过在相邻的台阶高度电极上逐步插入高压,可以迫使洗脱液进入数字微流体控制区,如图3和视频所示。萃取过程结束后,将洗脱液驱动到l型电极阵列上生成反应液滴,每个液滴约为5.55 μL。 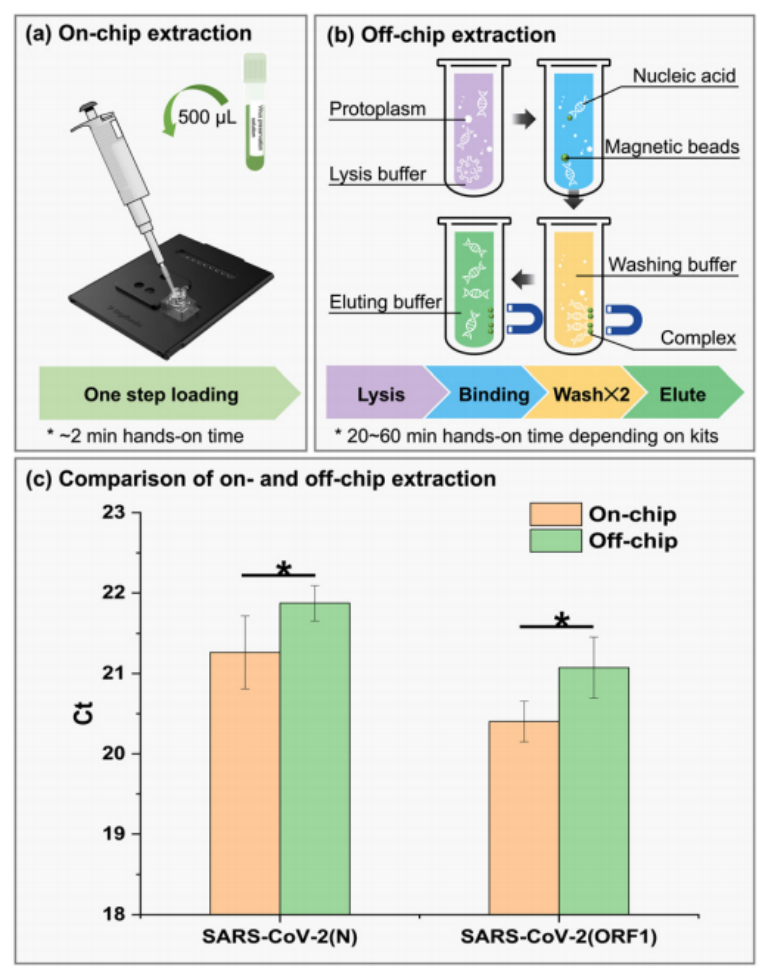 图4 片上和片外RNA提取比较程序和结果。两者之间的显著差异方法(p < 0.01)。 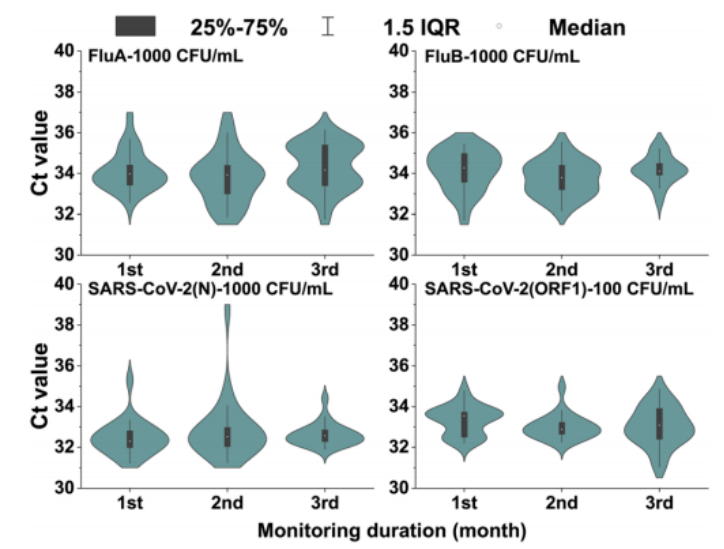 图5 稳定性测定时Ct值图 在芯片上的“sample-in-to-answer-out”工作流程的一百多次测试中表现出了卓越的稳定性。芯片上提取的循环阈值为N基因21.26±0.45,ORF1检测20.40±0.25,而它们分别为21.87 ± 0.22和21.08 ±0.38,由操作员使用商业化的试剂盒提取(图4).对于相同浓度的SARSCoV-2,N和ORF1基因检测的差异约为0.5。通过统计分析,与芯片外分析相比,芯片上分析可以达到回收率较少的阈值,这表明芯片提取的性能优于芯片外提取。由于在芯片中使用的体积较小,磁珠可以充分地接触到洗涤和洗脱缓冲液。因此,芯片提取的RNA浓度和/或纯度可能略高于手工提取。 临床应用表现 对11例SARS-CoV-2和甲型流感阳性临床标本和4例健康人群阴性标本进行了检测。结果显示,这两种病原体的芯片上和芯片外检测结果100%吻合。考虑到芯片在检测假病毒方面的良好性能,芯片上和芯片外方法测量的Ct值如预期的那样呈现出强正相关(图5),特别是对于甲型流感和ORF1基因的检测。这两个临床样本的芯片检测概率为7/8。由于芯片上的八个平行反应模型,减少了误诊的可能性。对于SARS-CoV-2,两种特定基因的检测可以双重验证结果的准确性。因此,该芯片在临床应用中具有可靠和令人信服的结果。 平台优势 VH 2.0仪器安装了4个荧光通道定制芯片有8个反应室,使理论检测能力达到32个目标。此外,还为病毒和细菌设计了自开发的裂解缓冲液,允许检测目标扩展到感染性细菌(如S. pneumoniae, H.influenzae, S. aureus, S. enterica, and S. flexneri,)。为了满足即时检测的要求,VH 2.0被设计为一个独立的墨盒,集成了GeneXpert、FilmArray,Onestart do.的核酸提取过程。萃取和反应所需的所有试剂都已预先储存在相应的空腔中,因此不需要额外的移液操作。相比于BD Viper™ XTR/LT和 Cobas® 4800/6800/8800 系统更加小巧且设备成本更低,大幅缩短了实际操作时间,简化了诊断流程,降低了对经验丰富的操作人员的需求。芯片制备采用PCB和预制块,可降低大规模生产过程中的成本和不良率。因此,它有利于产品的商业化。该平台在提取、扩增模块和样本应答过程方面表现出稳定的性能,其灵敏度、特异性、检测限和扩增效率均与芯片外RT-qPCR过程相当。通过简单地改变引物和探针,该平台就可以轻松地扩展到最多32个目标。此外,与传统的PCR相比,更适用于POCT的产品概念。对DMF在诊断领域具有一定的学术价值和应用价值。 论文链接:DOI: 10.1039/d3lc00728f |

