|
|
图解微流控|第40期发表时间:2022-03-22 16:47 微流控芯片实验室在 细胞研究中的应用(二) 13.2.2 细胞分选 细胞分选是从大量非均一细胞群体中获取某种特定细胞的一种技术,常用于细胞生物学和临床医学领域。目前常用的细胞分选技术以流式细胞仪(flow cytometry)为主,其原理如图13-8所示:分选前,待选细胞表面被标上特异性抗体,这种抗体又能够同某种荧光染料结合。细胞被标记之后,除去游离的抗体。把细胞稀释,稀释的细胞悬浮液被送入超声波振荡器,形成微小液滴,一个液滴中只含有一个细胞。带有荧光标记的液滴通过激光束时,会被干涉检测器(interference detector)和荧光检测器(fluorescence detector)同时检测到,此时液滴被充电并带上负电荷,向正极移动,进入到荧光标记细胞收集器中。当含有非荧光标记细胞的液滴进入激光束时,只会被干涉检测器检测到,此时液滴被充电并带上正电荷,向负极移动,被非荧光标记细胞收集器所收集。当不含有细胞的液滴进入激光束时,则不会被任何检测器所检测到,液滴不被充电,移动时不偏向,直接进入非检测的收集器。
图13-8 流式细胞分选原理示意图 流式细胞仪设备昂贵、体积庞大、需要专人操作,且细胞用量较大(>104),难以在实验室和医院得到广泛应用。微流控芯片的出现在一定程度上克服了这些局限性,且成本低下,并有可能实现仪器的小型化、集成化、自动化和便携化。基于微流控芯片的细胞分选方法包括:荧光激发分选、磁珠免疫分选、夹流分选、介电电泳分选、微过滤器分选和表面改性分选等。 13.2.2.1 荧光激发细胞分选 荧光激发细胞分选(fluorescence activated cell sorter, FACS)是微流控芯片细胞分选常用的一种方法,其原理与流式细胞仪相似。首先对细胞进行荧光标记,采用电动力、压力或空气夹流等形成鞘流的方式实现细胞进样,细胞流经激光诱导荧光检测区域后,根据检测到的荧光信号的有无或强弱,并借助多种控制方式(如电、光镊,泵阀等)进一步完成细胞分选。控制细胞流向的方法主要有:PDMS微阀,电场,激光光镊,机械控制阀,相变阀等。 (1) PDMS微阀 图13-9所示为PDMS变形阀控制荧光微珠分选芯片[5]。该芯片利用PDMS薄膜的变形性,通过两侧通道的挤压来控制出口通道的开关,从而控制细胞或荧光微珠的流向。这种细胞分选装置具有微型化和自动化等特点,光学分析体积小,有利于减少荧光背景干扰。
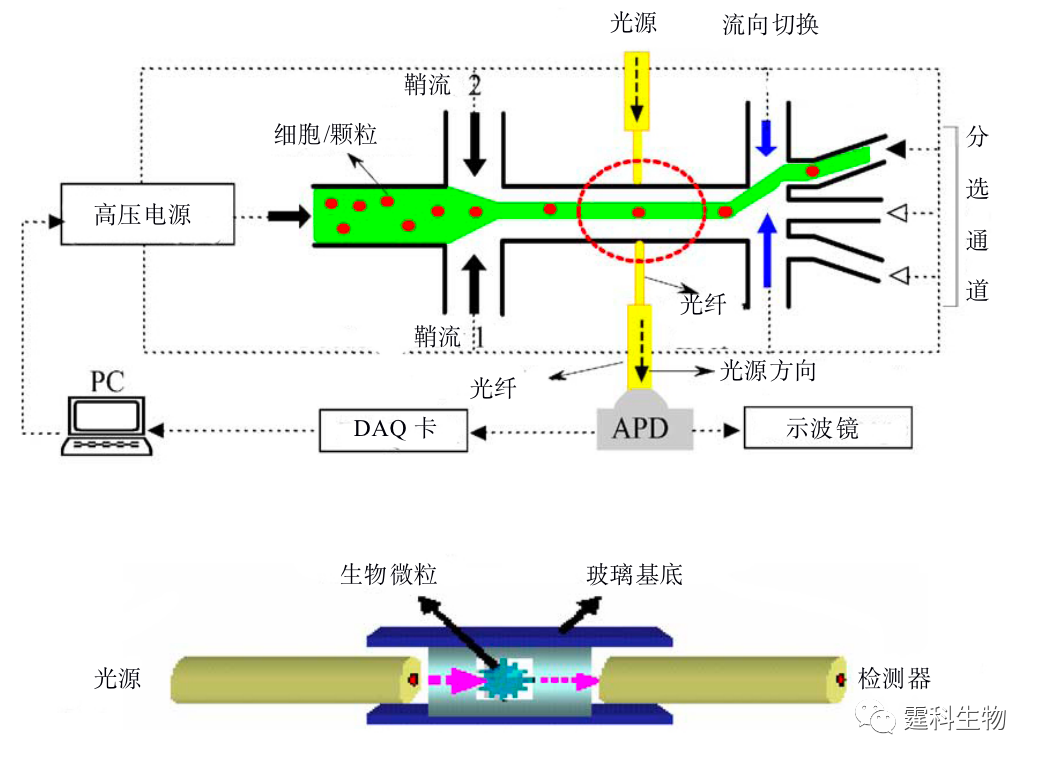
图13-9 PDMS变型阀控制细胞分选芯片[5] (a) 芯片结构示意图:通道宽100 µm,深100 µm,膜厚30 µm;(b) 细胞分选照片 (2) 电场 用电场切换细胞流向是简单而有效的方法[6-8]。图13-10是一套激光诱导荧光雪崩光电二极管检测的细胞分选装置图,细胞在鞘流作用下聚焦在通道中央,在均匀电场下,细胞受到电场力的作用,运动方向发生偏转,进入不同的收集池,实现分选。该装置的特点是将光纤埋入微通道,减少了光学原件的使用,简化了光路。
图13-10 激光诱导荧光雪崩光电二极管检测的细胞分选装置[6] (3) 激光光镊 通过显微镜物镜聚焦激光,利用光对物质的作用力,把一些介电粒子如微球、细胞等“捕获”在激光束的焦点附近,这种捕获细胞的方法被称之为“光镊”。光镊法具有微米级精确定位的特点,被捕获的粒子在施加外力后可以移动,位移大小与施加力的大小成线性关系。 光镊技术可用于荧光激发细胞分选[9,10]。如图13-11所示,细胞或颗粒在鞘流夹流作用下成单行经过检测区域,被CCD实时记录荧光图像,通过软件计算出细胞或颗粒的速度,根据大小不同的细胞或颗粒的速度分布信息,来启动激光光镊,施加不同的激光能量,使大小不同的聚苯乙烯颗粒受到的力不同,从而流向不同的收集池。
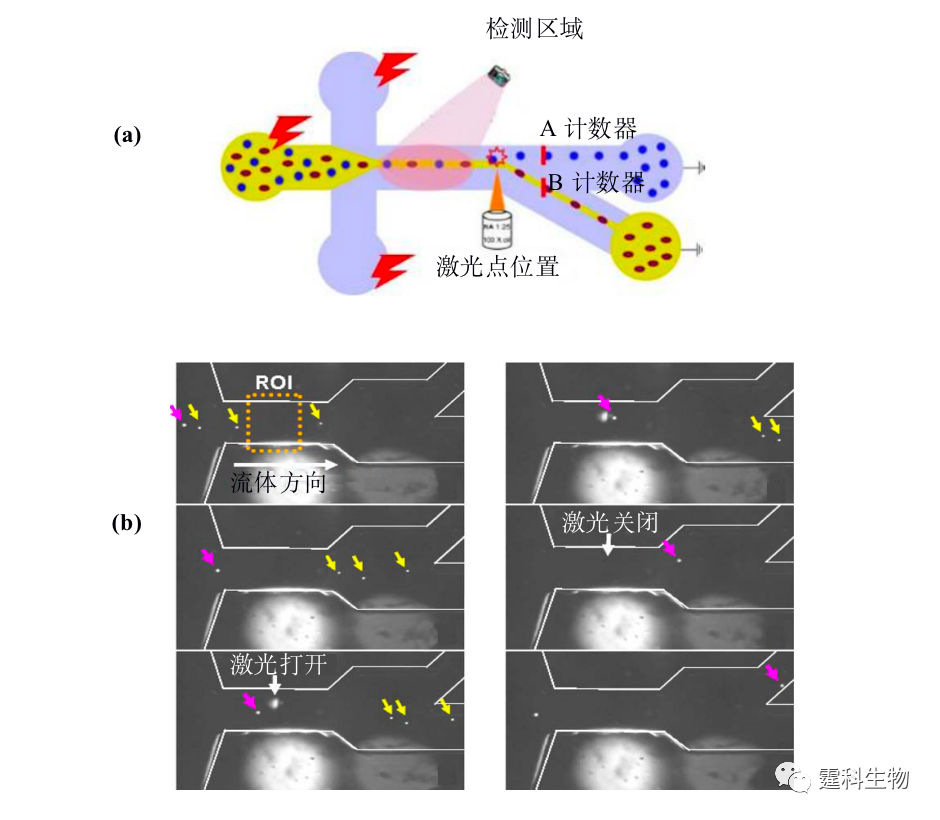
图13-11光镊细胞分选[9] (a)分选原理示意图;(b)分选10 µm和5 µm聚苯乙烯颗粒实时荧光图像 (4) 机械控制阀 将商品化的机械控制阀用于控制液流流向具有响应时间短,分析通量高等优点[11,12]。图13-12是一套简单的激光诱导荧光细胞分选装置,细胞在两侧缓冲液形成的鞘流夹流作用下成单行通过微通道,当光电倍增管检测到荧光信号后,细胞收集口控制阀将被打开,细胞进入收集池,整个响应时间仅为2.5 ms,分析通量高达每秒12000个细胞。
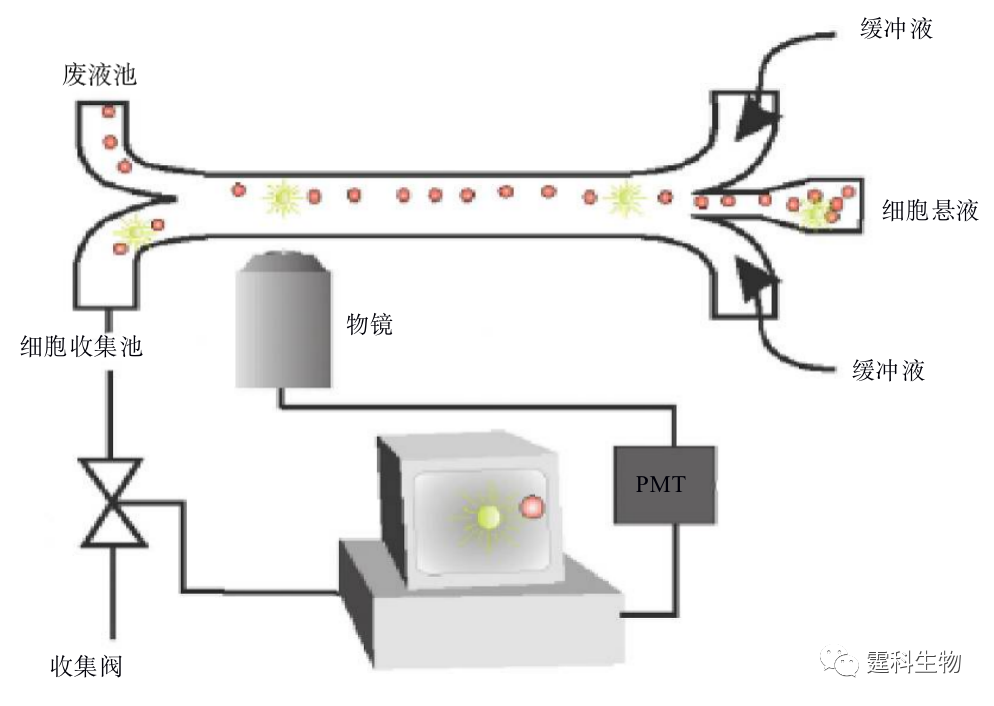
图13-12激光诱导荧光细胞分选装置示意图[11] (5) 相变阀 物质从一种形式转变为另一种形式称为相变。某些物质在较低的温度下就可以发生可逆的相变过程,利用物质的这种性质可用作液体流路的控制阀。Takashi等[13]建立了一套用溶胶凝胶相变阀来控制流路方向的细胞分选装置(图13-13),以红外线为热源控制Mebio胶的相变(相变温度为36℃),温度低于36℃ Mebio胶成固态,流路关闭,反之,则开启。据此分选了荧光微球和荧光标记的大肠杆菌,其响应时间仅3 ms。
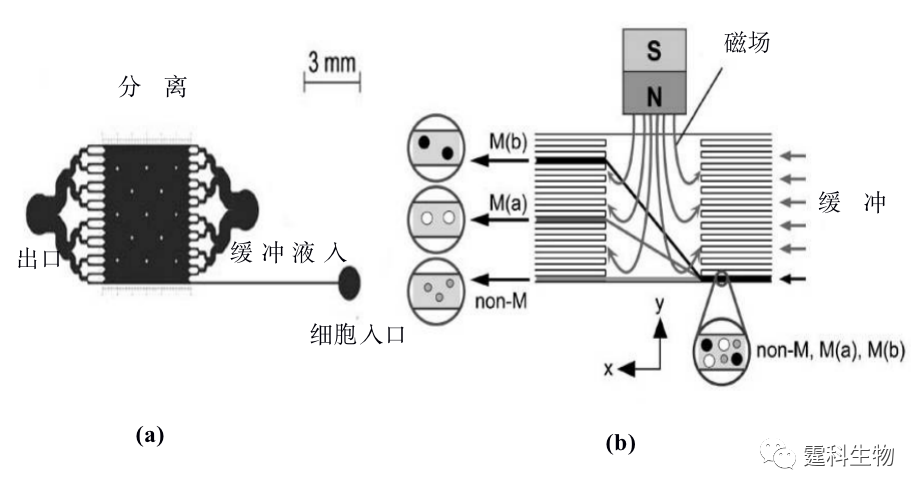
图13-13溶胶凝胶阀分选大肠杆菌原理图和示意图[13] (a)溶胶凝胶分选细胞原理图:检测到荧光颗粒信号时,激发红外热源,使废液通道的Mebiol胶凝固,细胞流向收集池;(b)绿色荧光蛋白表达的大肠杆菌进入收集通道的连续荧光图片 13.2.2.2磁珠免疫细胞分选 磁珠免疫细胞分选原理是:磁珠表面包被了特异性抗体,在外加磁场作用下,能与磁株表面抗体特异性结合的细胞被滞留在磁场中,不能与磁珠上的特异性抗体结合的细胞,没有磁性,不在磁场中停留,被流体带走,从而使不同的细胞得到分离。Furdui[14]等设计了简单的Y型结构芯片,通道表面修饰有表面结合CD-3抗体的蛋白A磁珠,通过CD-3抗体蛋白与T淋巴细胞的特异结合,使只含万分之一的T细胞被捕获富集,其它细胞则流出通道,以此实现Jurkat-T细胞与血细胞的分离 将磁力作用和微通道内的层流特征结合起来,在微流控芯片上发展了一种自由流磁泳(free-flow-magnetophoresis)细胞分选方法[15]。图13-14是自由流细胞分选芯片和原理示意图。细胞从阵列通道中最下面的一根通道泵入,其余通道则泵入缓冲液。未标记纳米磁珠的细胞,不受磁力作用,在层流作用下不发生偏转,只会从右侧的对称通道流出。标记了纳米磁珠的细胞,在外加磁场的作用下,因所受的磁力大小不同,会发生不同程度的偏转,从不同的通道出口,因此实现了鼠巨噬细胞和人卵巢癌细胞的分离。
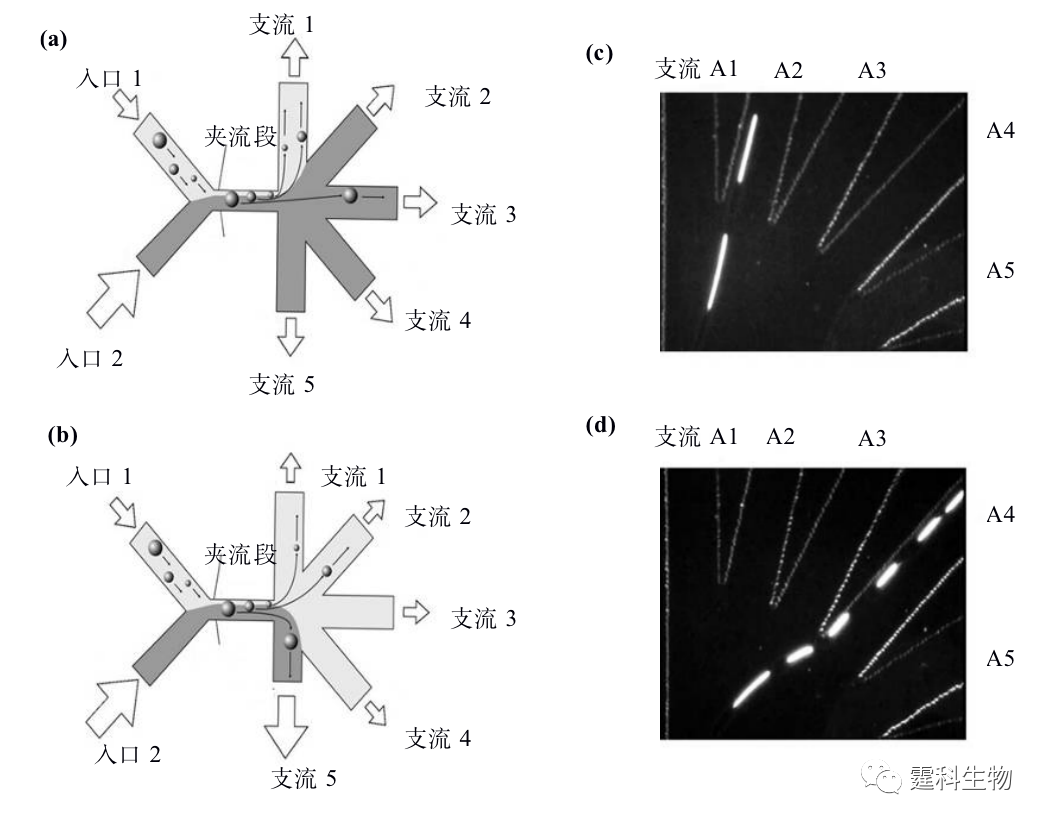
图13-14 自由流磁泳细胞分选微流控芯片[15] (a) 芯片示意图;(b) 分离原理示意图 13.2.2.3夹流细胞分选 Takagi等[16]提出利用夹流分选法(pinched flow fractionation,PFF),来连续分离大小不同的颗粒,并结合末端非对称多分支通道进一步提高分离效率,其原理如图13-15所示。流体在微通道中呈层流状态,颗粒随着流体稳定流动,如果受到另一侧通道的流体挤压,其中的颗粒都会被挤压在管壁上,管道直径增大时流线会随着扩散,大小不同的颗粒将随其中心位置所对应的流线而被分离开来。随后,他们又采用类似的方法,实现了芯片上血液中的白细胞[17]以及单核核双核肝细胞[18]的分离。
图13-15 夹流挤压细胞分选原理示意图[16] (a) 对称型夹流细胞分选芯片;(b) 非对称型夹流细胞分选芯片;(c) 当排液出口关闭时荧光颗粒流向支流出口2;(d) 当排液出口开放时荧光颗粒流向支流出口4 13.2.2.4介电电泳细胞分选 介电电泳(dielectrophoresis,DEP)是指电中性颗粒放置于非均匀电场下,会产生诱导极化并与电场相互作用而产生介电泳动现象。当溶液的极化率大于颗粒的极化率时,产生负向介电泳(negative DEP,nDEP),颗粒向场强最低的区域移动。反之,则为正向介电泳(positive DEP,pDEP),颗粒向场强最高的区域移动。在非均一电场下,根据不同细胞所受到的介电泳力不同而实现分离,介电泳力的大小和方向主要与外加电场的频率、溶液和细胞的介电特性、电导率以及细胞的大小有关。 根据产生空间非均一电场的方式不同,目前所涉及的介电电泳大致可分为电极式介电泳和绝缘介电泳两种。 (1) 电极式介电电泳 电极式介电泳通常利用MEMS技术在微通道内集成金属微电极,然后加上交流电来形成非均一电场。根据电极的空间分布可以分为平面电极和三维电极。 根据电极形状不同平面电极又可分为城垛型电极和阵列平行电极。 图13-16所示的是利用叉指状城垛型电极分选人肺癌细胞的例子[19]。其中活细胞受到正向介电力的作用被捕获在电场强度最大的区域,死细胞受到负向介电力的作用被捕获在电场强度最弱的区域。
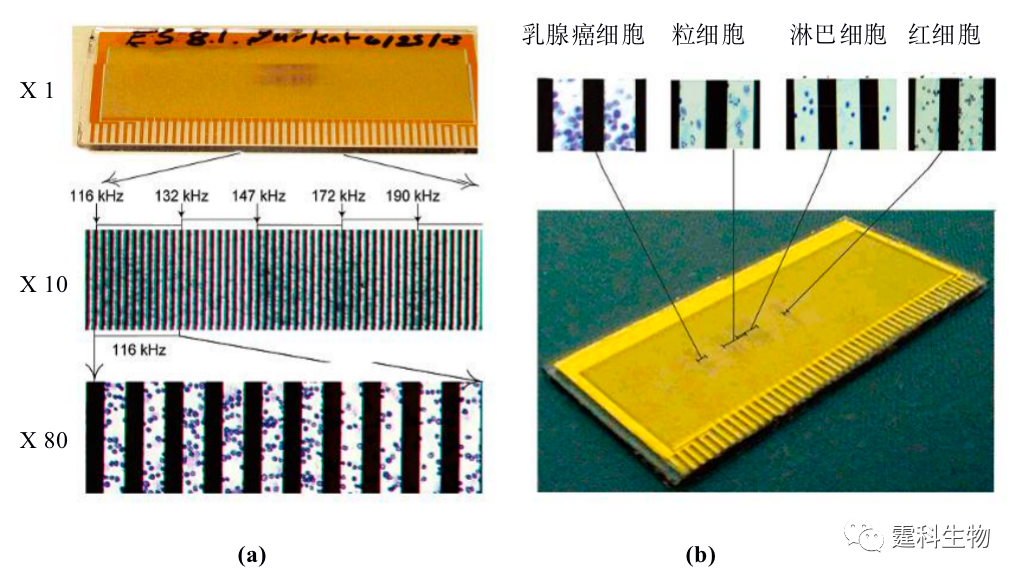
图13-16城垛型电极芯片分选死细胞和活细胞[19] (a) 活细胞受到正向介电力作用被捕获在电场最强区域;(b) 死细胞受到负向介电力作用被捕获在场强最弱区域;(c) 死细胞与活细胞分离结果 图13-17所示的是整合了多组不同频率的微阵列平行电极芯片[20]。当细胞处于不同频率的非均匀电场时,不同细胞因所受到的介电力大小不同,被吸附在芯片的不同位置,从而实现细胞分选。由于肿瘤细胞和正常细胞大小不同,所受的介电力不同,据此可将Jurkat-T淋巴瘤细胞从与血液细胞的混合液中分离出来。这种方法适于外周血中脱落癌细胞的检测,为肿瘤微转移的诊断提供了一个有效途径。
图13-17 阵列平行电极细胞分选图[20] (a) 阵列电极频率分布和Jurkat-T细胞被捕获在116 Hz频率位置;(b) 从人外周血中分离出MDA-435乳腺癌细胞照片 三维电极根据电极形状不同有柱状电极和上下对称电极之别。 相对于平面电极来讲,三维电极制作比较麻烦,但这类电极产生的电场作用范围更广,其正向或负向介电力更强,更有利于细胞捕获和分选。Voldam等[21]利用MEMS技术制作了如图13-18所示的8个阵列三维柱状电极,每四个电极构成一个细胞捕获单元,同时通过控制电极的开关,可以有选择性的捕获或释放某个特定的细胞,实现单细胞灵活操控。
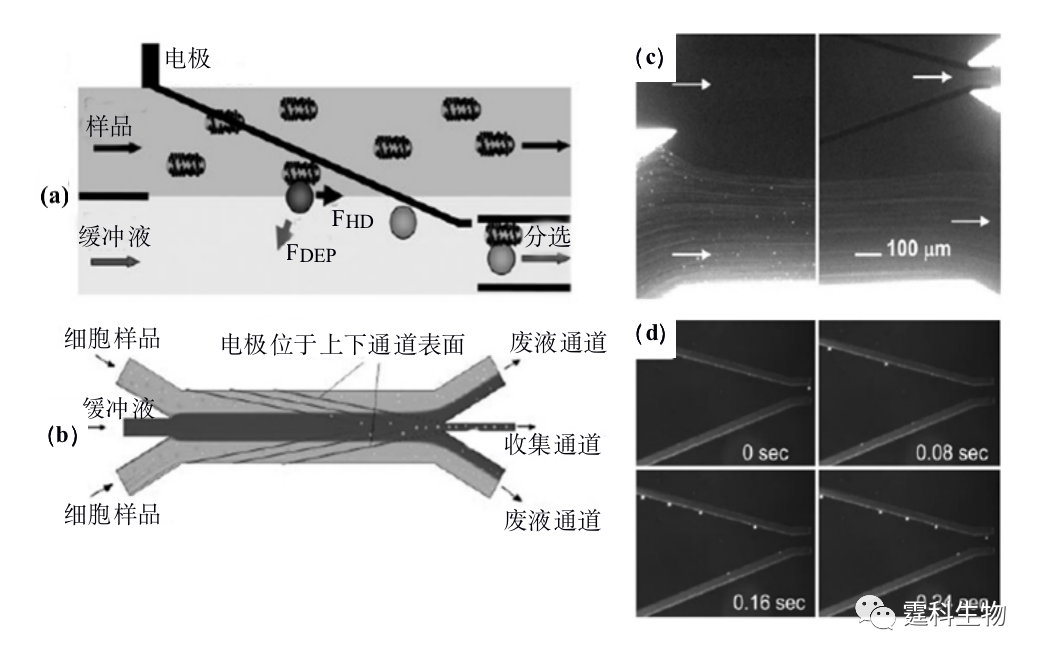
图13-18 柱状电极阵列芯片捕获和分选单个颗粒及细胞[21] (a) 8个阵列的柱状电极示意图,每四个电极为一个阵列捕获单个颗粒或细胞;(b) 捕获和释放微珠颗粒以及HL-60细胞图像 另一种空间三维电极是在通道上下表面刻蚀对称的线性电极。图13-19是Hu等[22]设计的一种三维介电电泳芯片。在连续流和介电场作用下,细胞悬液流经芯片两侧的通道,标记有介电响应标记物(生物素化的T7标记物单克隆抗体)的目标细胞,受到较强的负向介力作用而偏离流体方向运动,进入中间细胞收集通道。采用这一策略可极大提高分选的灵敏度和通量,每秒内可分选104个细胞,回收率达95%。
图13-19上下对称三维电极芯片细胞分选原理和荧光图像[22] (a) 介电电泳颗粒受力分析:介电响应标记物标记的颗粒受到负向介电力和流体方向力作用合力后,偏离流体方向进入收集通道;(b) 细胞分选芯片示意图;(c)未经标记的颗粒受到很弱的介电力,运动方向不发生改变,随流体进入废液池;(d) 在介电力作用下,标记后的聚苯乙烯微球沿电极方向运动,进入中间细胞收集通道 (2) 绝缘介电电泳 绝缘介电泳(insulating DEP,iDEP)[23]是指在微通道内安置绝缘的结构,当通道两端加上直流电压,这种绝缘结构可以在流体中挤压电力线形成非均一电场,也就是所谓的非电极式介电泳。由于不需要制作金属电极,也不会因为电解而产生气泡,因此iDEP芯片得到了越来越多人的关注。Fintschenko和Li两个研究小组在这方面作了较多的工作[24-28]。图13-20是以液滴为绝缘介质来挤压电力线形成非均一场,分离不同大小的荧光粒子的芯片,通过改变油滴的大小,可任意改变电力线的分布,增加操作的灵活性[24]。
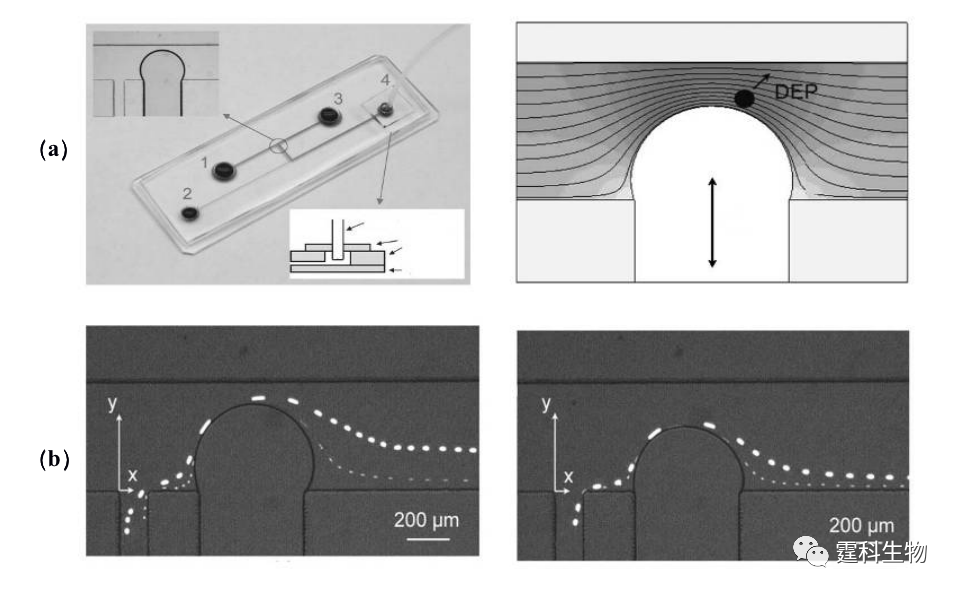
图13-20绝缘介电电泳分离大小不同荧光颗粒示意图[24] (a) 芯片结构和绝缘液滴挤压电力线形成非均一场示意图;(b) 绝缘液滴直径46 μm,分选粒径为5.7 μm和15.7 μm荧光颗粒 细胞介电电泳分离技术具有许多优点:第一,不需要添加抗体,因此,细胞不会在分离过程中因抗体反应而发生生物性质改变。第二,所用交变电场对细胞的作用是“非破坏性”的。第三,这类技术的使用灵活、电场强度、频率、相位都容易调控,便于自动化。第四,该技术还可与其它方法结合使用,以达到最佳的细胞分离检测效果。例如,将DEP与重力场分流联用可用于乳腺癌细胞和正常血细胞混合物的分离[29-31]。 13.2.2.5微过滤器细胞分选 在微流控芯片上利用微机械加工技术刻蚀微米级的网格或通道作为细胞过滤器,根据细胞的大小实现分选。图13-21所示是芯片单细胞微过滤器,在硅玻璃芯片上刻蚀有间隔几微米的坝形状结构,由于癌细胞和外周血细胞直径大小不同,可将成神经细胞瘤细胞从外周血混合液中分离出来[32]。同理,可利用红细胞和白细胞直径大小的差异,从全血中分离出白细胞[33,34]。
图13-21芯片单细胞微过滤器[32] (a) 微通道尺寸5-20 mm;(b) 根据细胞尺寸大小分选成人红细胞和NB细胞图像 13.2.2.6 表面改性细胞分选 芯片表面进行特异性修饰,利用不同细胞对通道表面的选择性黏附特征来捕获特定细胞,达到细胞分选的目的。Zheng等[35]将凝集素固定在微通道表面,根据细胞表面对凝集素亲和能力的不同分离了两种不同的细胞。也可将特异性抗体键合在微通道表面,用于捕获人血白细胞[36]或者癌细胞[37,38]等。 总体而言,以微流控芯片为平台的细胞分选技术具有微型化、集成化、细胞用量少、污染概率低等特点,可根据实际需要选择合适的技术,达到有效分选细胞的目的。 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |