|
|
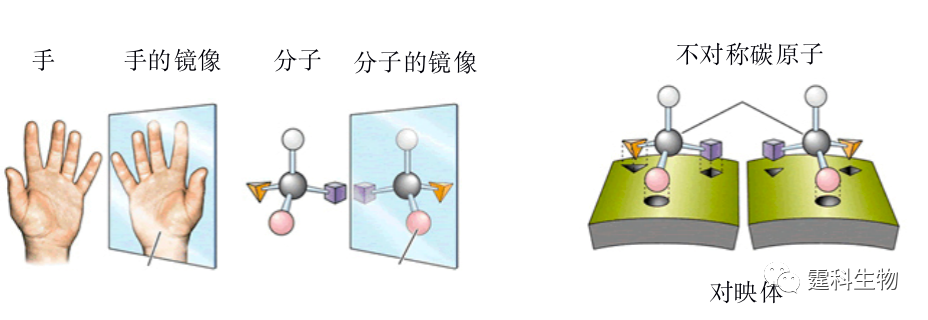
图解微流控|第37期发表时间:2022-03-11 13:29 微流控芯片实验室在离子和 小分子研究中的应用(二) 12.2手性分子 分子的手性(chirality)现象由法国生物学家巴斯德在19世纪中叶发现,20世纪由于手性药物对映体在疗效上的巨大差异引起科学界和产业界的广泛关注。时至今日,手性分子已经在医药、农药、香料以及精细化工品中发挥着重要作用,与人类的生产生活密切相关。微流控芯片在手性分子研究领域的两个重要分支,手性合成和手性拆分上均有涉及,并在某些方面显示出微型化后的独特优势。 12.2.1 基本概念 手性 表达化合物分子因原子三维排列引起结构不对称性的术语[20]。 对映体 像人的左右手,彼此呈实物和镜像的关系称为“对映关系”,将具有对映关系的两种分子互称为“对映体”,如图12-7所示[21]。对映体的特点是二者物理化学性质均相同,唯一差别在于旋转偏振光的方向相反。
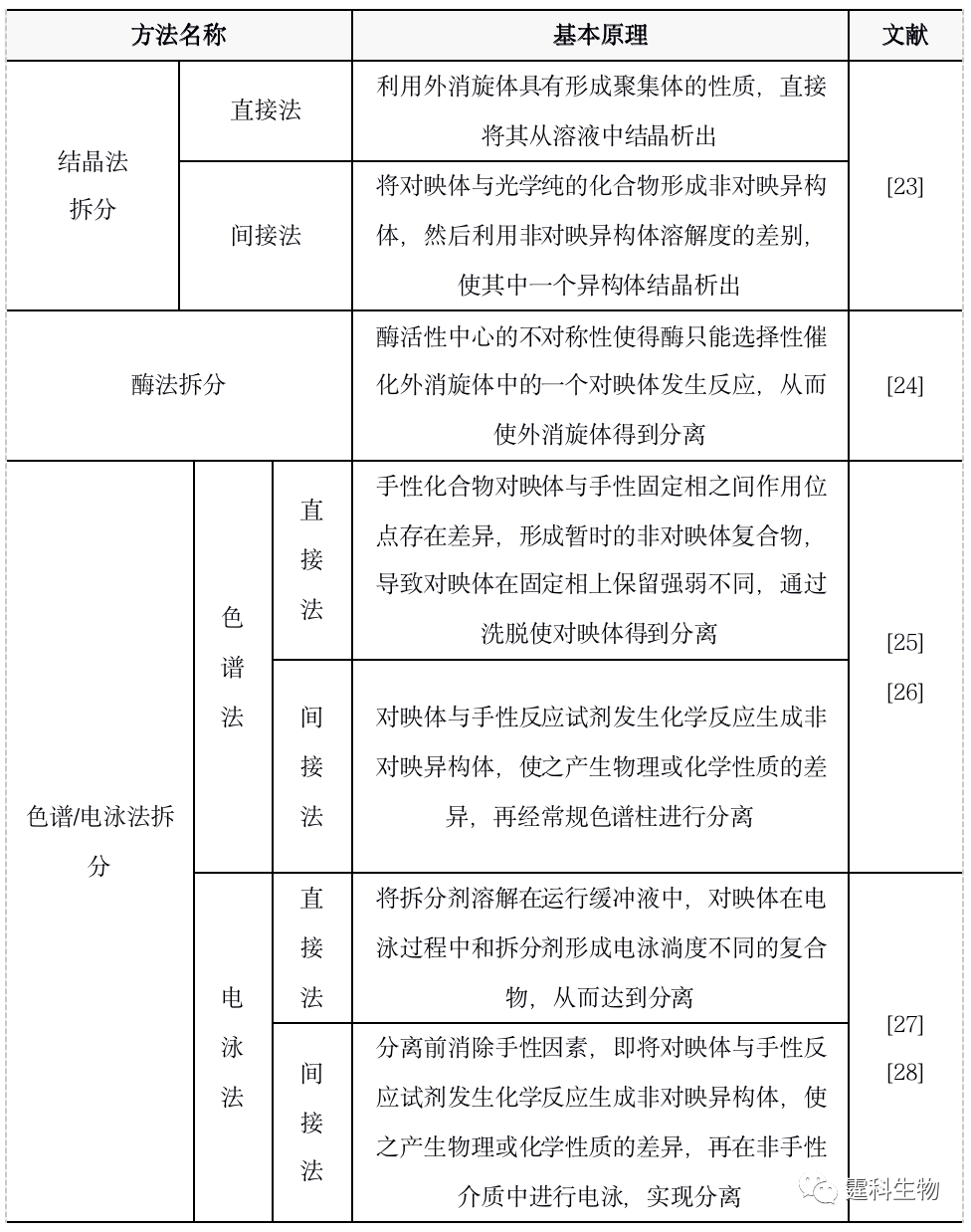
图12-7 对映体示例[21] 对映体分析的重要性 考察对映体在生理活性(有效性、毒性)、传输机理和代谢等方面是否存在差异是药物研发中必须考察的环节。对映体的纯度检测是手性合成评估的重要指标。 手性拆分 手性拆分是将外消旋体(对映体等量混合物)通过物理或化学手段分离开来形成单一对映体的过程。手性拆分是对映体分析的必要条件,也是制备单一对映体的途径之一。表12-3列出了常用的手性拆分方法。 表12-3 手性拆分方法一览表
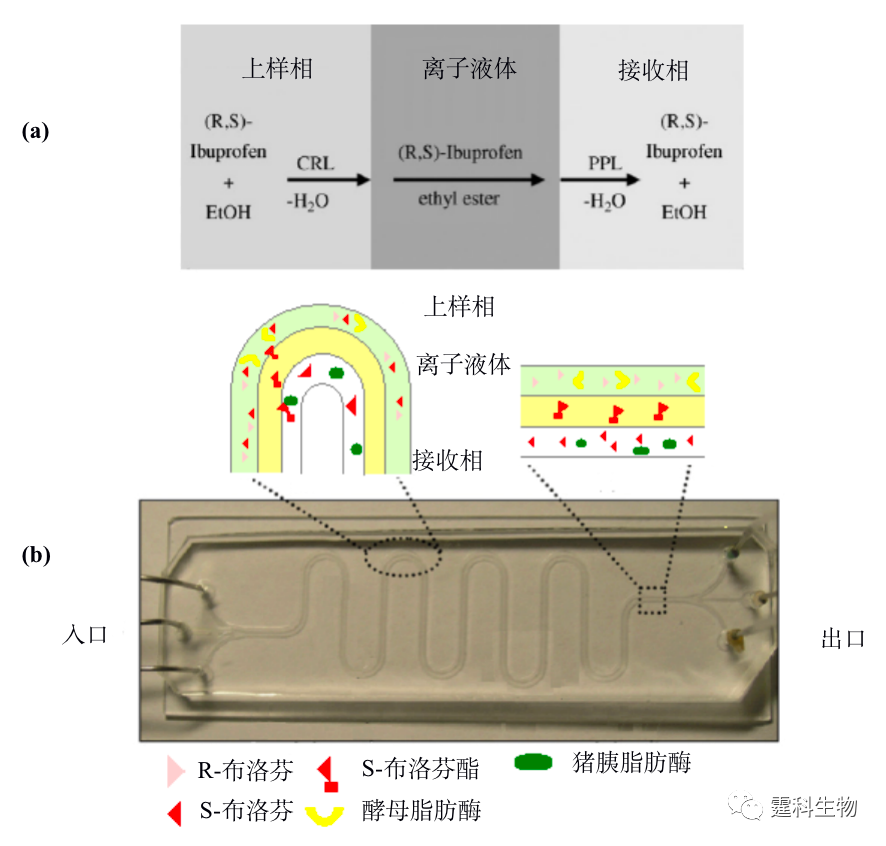
手性合成 又称为不对称合成,是一个将潜手性单元转化为手性单元,进而产生不等量的立体异构体的过程[22]。 12.2.2 手性拆分 在表12-3所述手性拆分方法中,酶法拆分,色谱和电泳法拆分均已在微流控芯片上有所尝试。拆分平台的芯片化使拆分速度大大提高,试剂和样品用量减少至微升级,具有发展高通量和集成化的潜力。 12.2.2.1 酶法拆分 微流控芯片酶法拆分消旋体的研究刚起步,尚有较大的研究空间,相关报道仅有Hong等[29]进行的酶法拆分布洛芬消旋体(R,S-ibuprofen),见图12-8。其中图12-8(a)为微流控芯片利用离子液体选择性迁移S-布洛芬原理,上样相为含有消旋布洛芬和假丝酵母脂肪酶(CRL)的水相,中间相为离子液体,接收相为含猪胰脂肪酶(PPL)的水相,假丝酵母脂肪酶选择性地酯化S-布洛芬,酯化后的S-布洛芬溶解于离子液体中,并扩散至接收相,接收相中的猪胰脂肪酶将其水解成S-布洛芬;图12-8(b)为芯片实物图及三相液流局部放大示意图。
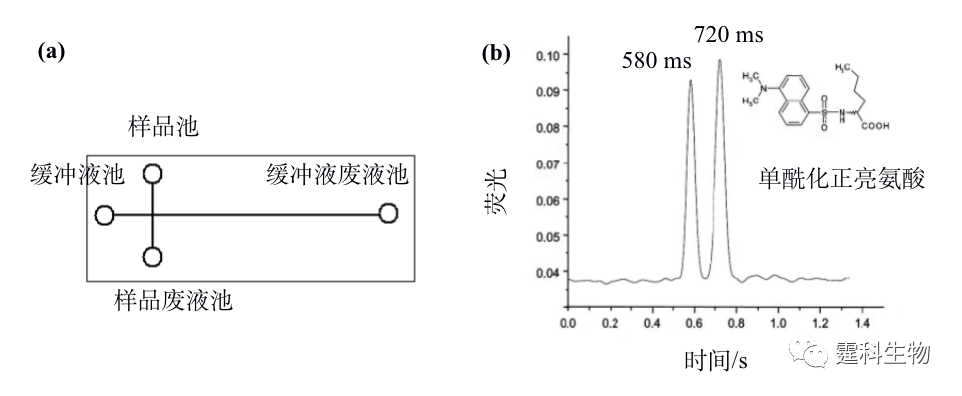
图12-8 微流控芯片酶法拆分布洛芬[29] 12.2.2.2 电泳法拆分 电泳法拆分因简单易行成为目前微流控芯片采用最多的手性拆分方法[30-39]。就拆分方式而言,以直接法居多,即将拆分剂加于运行缓冲液后施加电压上样及电泳分离即可。这种拆分方法在微流控芯片上的运用使拆分时间通常以秒甚至毫秒计算,体现了芯片手性拆分最为显著的优点,即拆分速度快。缩短单次拆分时间是实现高通量手性拆分的重要途径之一。目前,微流控芯片在手性拆分中的探索多数体现芯片在这方面的优势。图12-9是迄今为止最快速的手性拆分结果,单酰化正亮氨酸的两个对映体的拆分在0.8 s内完成。
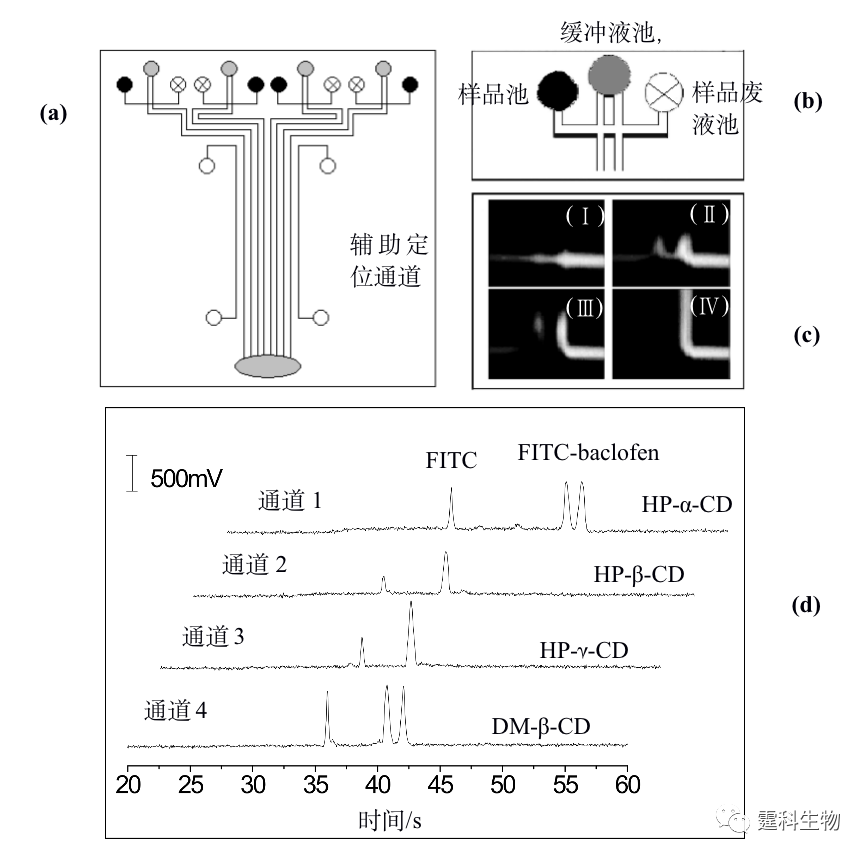
图12-9 单酰化正亮氨酸手性拆分[38] (a) 芯片结构示意图;(b) 手性分离单酰化正亮氨酸电泳谱图。有效分离长度:1.5 mm;缓冲液:25 mmol/L 三乙胺-磷酸+2% HS-γ-CD,pH 2.5;电场强度:2012 V/cm 就分离通道数量而言,微流控芯片电泳手性拆分可以分为单通道拆分和多通道拆分两类。多数相关报道集中于单通道手性拆分,多通道手性拆分研究以作者实验室率先开展[40, 41]。多通道芯片可同时分析不同样品或考察不同条件,是实现高通量手性拆分的另一重要途径。图12-10是作者所在实验室开展的多通道芯片电泳手性拆分示例。图(a)是芯片结构示意图,此芯片包括4组独立的电泳单元,因采用了旁路辅助静压力进样模式,各分离通道旁均有一辅助通道, 4组分离通道的外侧各有一定位辅助通道,用于充满荧光染料确定检测位置;图(b)为储液池和进样区域的局部放大图;图(c)为旁路辅助静压力进样原理;图(d)为4种拆分剂拆分FITC-baclofen电泳谱图,其中HP-α-CD和DM-β-CD两种拆分剂能将FITC-baclofen对映体基线分离。
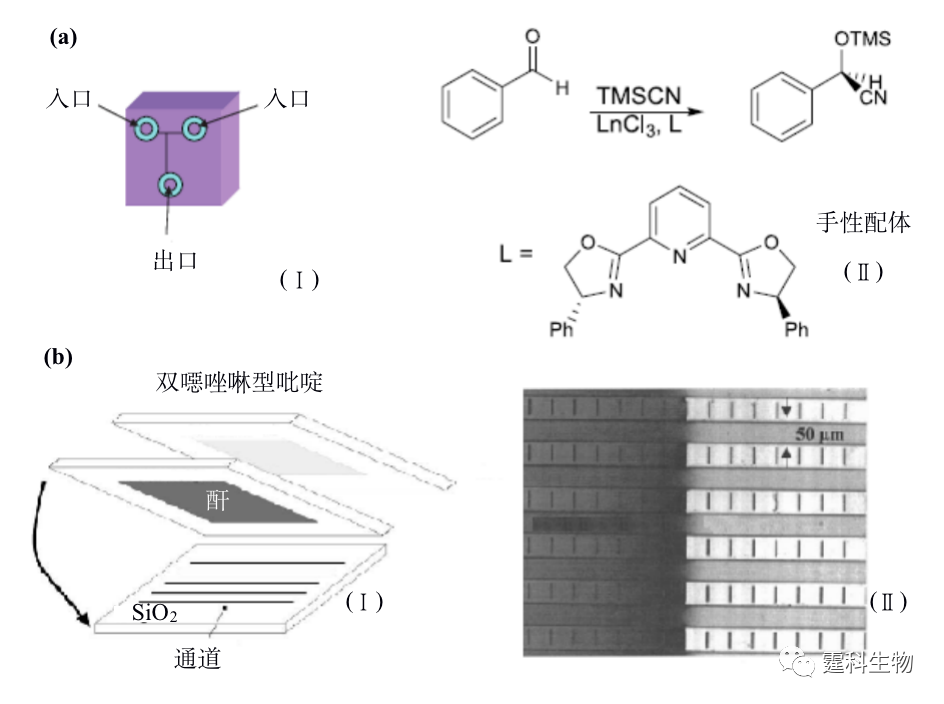
图12-10 多通道芯片平台四种拆分剂同时拆分FITC-baclofen[41] 12.2.3 手性合成 手性合成是获得光学纯化合物的重要途径之一,也是近年来有机合成领域的研究热点。手性合成主要通过在反应体系中引入手性催化剂实现立体选择性反应。设计与合成高效、高选择性、适用范围广和廉价易得的催化剂以及合成新的手性中间体是目前手性合成研究的重要方向,这些研究通常需要经过大量实验摸索和条件优化。反应系统微型化加快了传质、传热速度,可能提高反应效率和速度,并大大降低试剂与样品的消耗量,有望使上述过程的进程大幅加快,因而受到合成工作者的关注。微流控芯片应用于手性合成领域的时间不长,相关报道不多。具有代表性的是Haswell等将芯片刻蚀出通道作为反应器,以电渗驱动镧系金属催化苯甲醛生成手性氰醇化合物的反应,见图12-11(a)[42],其中图(Ⅰ)为芯片结构示意图,将苯甲醛、催化剂及手性配体混合均匀后和另一反应物TMSCN分别注入两入口,在电渗驱动下液流流向出口的过程中发生反应,图(Ⅱ)为合成手性氰醇的反应式。也有利用芯片比表面积大的特点,将微流控芯片用于连续微印记法固定化手性配体,见图12-11(b)[43],图(Ⅰ)为芯片通道连续微印记示意图,图(Ⅱ)为湿法测试微印记效果,即将甲醇滴至芯片左边有印记分子处被截留,说明印记效果良好。
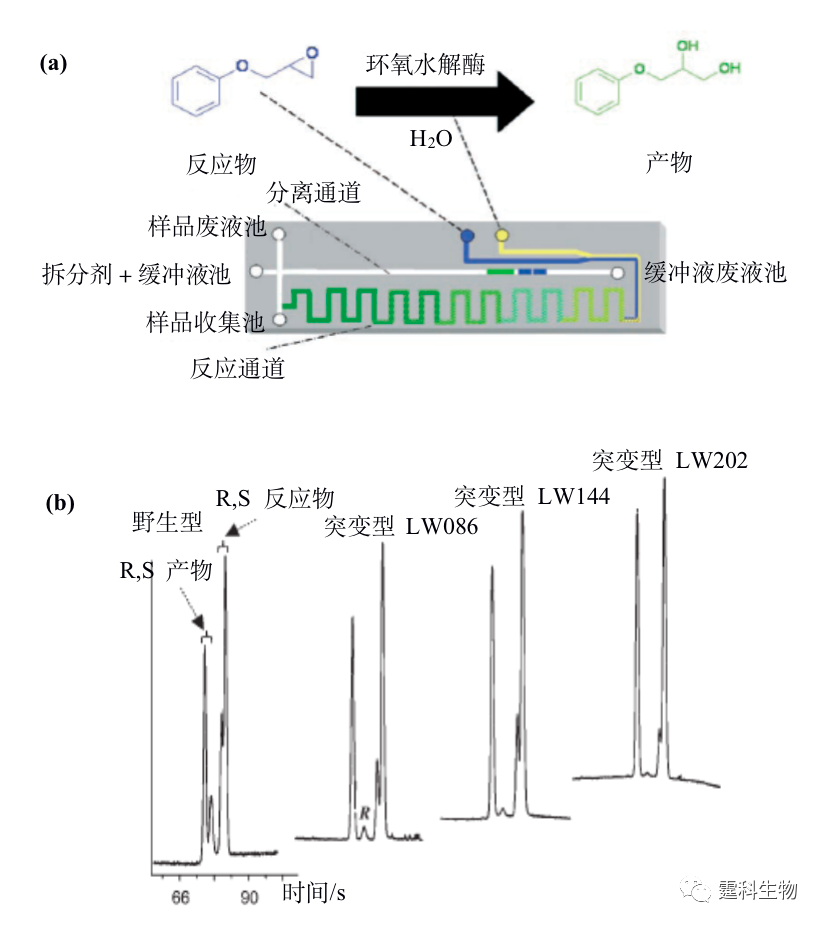
图12-11 微流控芯片在手性合成中的应用[42, 43] 12.2.4 手性合成-手性拆分集成 微流控芯片技术的发展目标之一是将传统实验室的各种操作集成在一块微小芯片上。手性反应与拆分在微流控芯片上的实现为二者的集成奠定了基础。手性合成与拆分的集成使反应和评估系统处于同一量级,具有发展高通量的潜力。目前已报道的集成模式是游离酶水相反应与区带电泳手性拆分的集成[44],见图12-12,该工作展示了微流控芯片手性合成与拆分集成的可行性和优势。但是手性合成种类繁多,如水相和非水相反应、均相和异相反应、一步和多步反应等等,这些反应和怎样的拆分方法相匹配,又该如何实现这两个单元的连接仍是值得探讨的问题。
图12-12 不对称反应-手性拆分集成式芯片工作原理及结果[44] (a) 不对称反应-手性拆分集成式芯片示意图及工作原理,酶作为催化剂添加到缓冲液中,经电渗或真空泵驱动进入反应通道,产物到达样品收集池后进行电泳拆分,检测反应物和产物的自荧光;(b) 野生型和三种突变型环氧水解酶的催化性能检测,通过电泳拆分检测结果计算产物对映体相对含量对四种环氧水解酶催化性能进行评估 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |