|
|
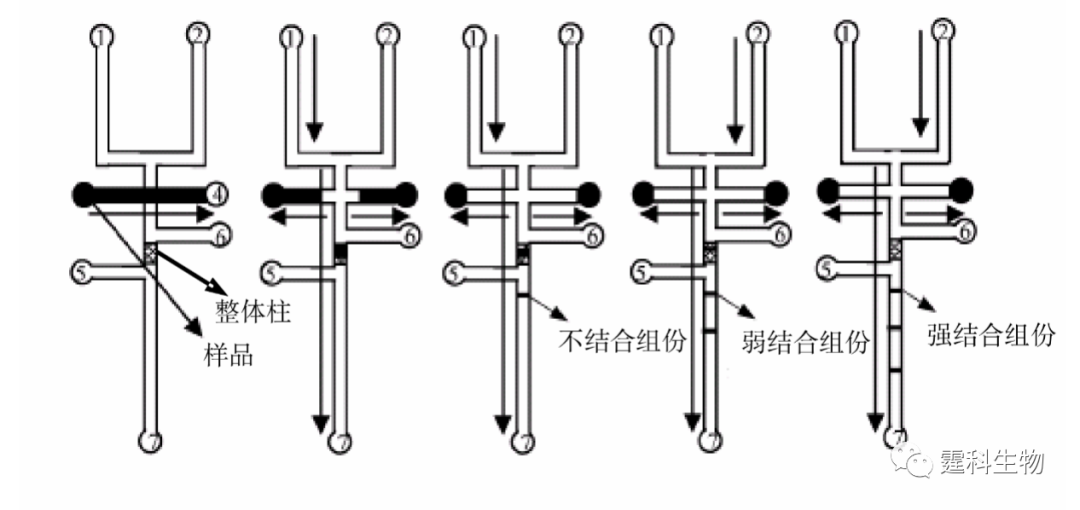
图解微流控|第35期发表时间:2022-02-25 10:31 微流控芯片实验室在蛋白质研究中的应用(三) 11.2.3 蛋白质的功能研究 11.2.3.1 蛋白质的糖基化 蛋白质的糖基化在很多生物过程如分子识别、信息传递中发挥着重要的作用,而糖链在整个过程中起到特异性的识别和调控作用,对糖蛋白中的糖基化分析是认识和了解糖蛋白功能的关键。蛋白质糖基化的分析主要包括两个方面:糖基化位点的确定和其所含糖链的结构分析。微流控芯片作为一种集成化的平台,可以将一些复杂、繁琐的过程简化,并减少分析时间和样品消耗量,是进行蛋白质糖基化分析的理想选择。 ① 糖形的分析 糖与凝集素的结合常数可作为糖链结构测定的一个参数,而凝集素亲和色谱不仅可以测定其结合常数,还可以对糖蛋白的不同糖形进行分离。作者实验室构建了一种凝集素亲和色谱芯片,芯片通道内有一段500 μm的固定有凝集素的整体柱,它可以使亲和、洗脱等过程集成在一起完成,具有操作简单、分析速度快、样品消耗量低等特点[26]。整个操作流程见图11-26:糖蛋白进入固定有凝集素的整体柱中,与凝集素结合的糖形被保留,不与凝集素结合的糖形流出。被凝集素捕获的糖形用不同浓度的半抗原单糖洗脱,与凝集素弱结合的糖形可以被低浓度的半抗原的糖替代先流出,与凝集素强结合的糖形则需要高浓度的半抗原的单糖替代后流出。因此糖蛋白的糖形可以被分为不与凝集素结合、与凝集素弱结合以及与凝集素强结合的三个组份。
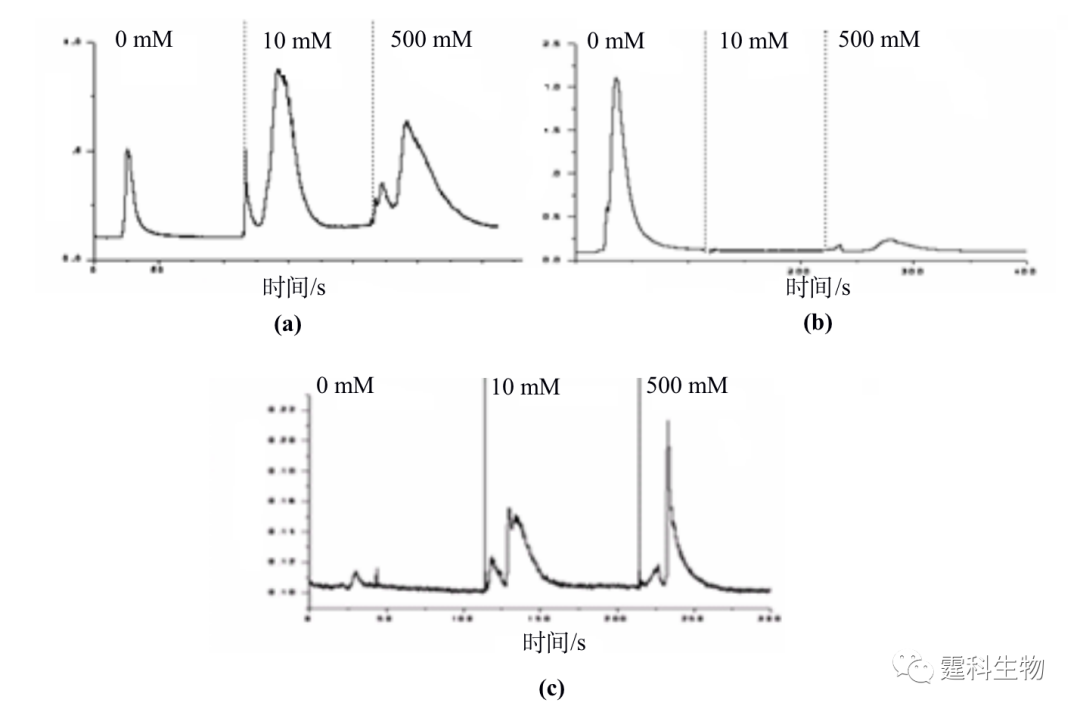
图11-26 集成化的凝集素亲合微流控芯片[26] 图中所示:1.缓冲液池;2.洗脱液池;3.样品池;4.样品废液池;5、6.芯片冲洗池;7.废液池 将豌豆凝集素键合在该集成化的凝集素亲合芯片的整体柱上,图11-27为含有不同类型的N-连接糖链结构的糖蛋白的糖形在该凝集素亲和芯片上的分离谱图。豌豆凝集素可以与含有a-甘露糖的糖链以及连接有岩藻糖的乙酰化的壳二糖结合,鸡卵白蛋白含有高甘露糖型和杂合型的糖链,如图11-27 a所示,其糖形经豌豆凝集素亲和芯片分离后可以得到三组,即与豌豆凝集素不结合组份、与豌豆凝集素弱结合组份和与豌豆凝集素强结合组份。卵粘蛋白含有的12种糖链中只有一个高甘露糖的糖链,其余的糖链为复杂型的糖链,其糖形经豌豆凝集素亲和芯片分离后得到两个组份,即与豌豆凝集素不结合的组分和与豌豆凝集素强结合的组分(见图11-27(b))。迄今为止还没有关于火鸡卵白蛋白含有的糖链的具体结构报道。图11-27(c)为其糖形在豌豆凝集素亲和芯片上的分离图谱,两个组份分别为与豌豆凝集素弱结合和与豌豆凝集素强结合的组份。比较图11-27(a)和11-27(c)发现,尽管鸡卵白蛋白和火鸡卵白蛋白为同一类糖蛋白,但来源于不同物种的糖蛋白含有不同的结构糖链。
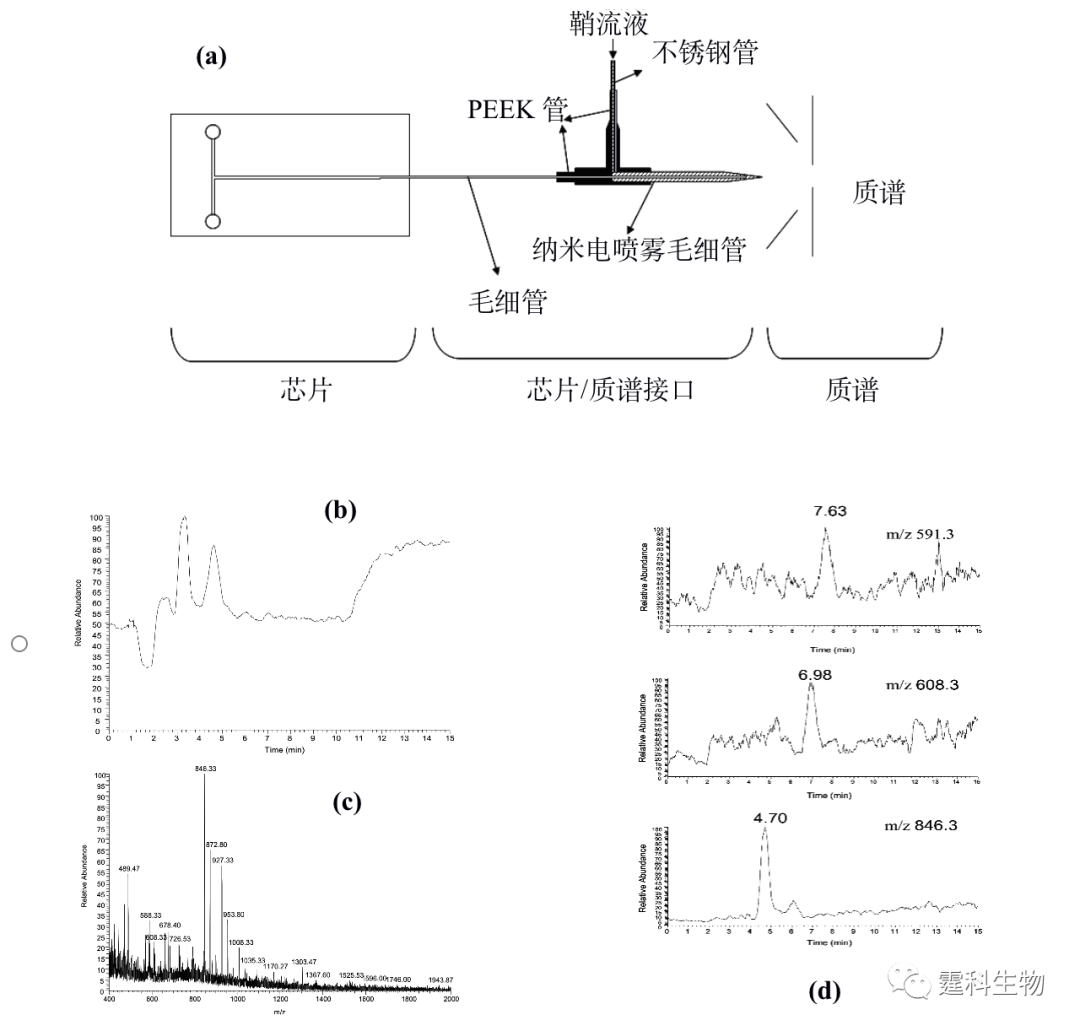
图11-27 含有不同结构糖链的糖蛋白在豌豆凝集素亲和芯片上的分离图谱[26] (a) 鸡卵白蛋白质;(b) 卵粘蛋白质;(c) 火鸡卵白蛋白的糖形。图中浓度为甲基甘露糖的浓度 ② 糖肽的分析 分析糖蛋白中的糖肽,不仅可以测定糖蛋白的糖基化位点,即糖肽中肽的氨基酸序列,还可以进行糖蛋白所含的糖链结构的分析。作者实验室和香港大学合作构建了一个通过鞘流液辅助的纳米电喷雾接口将芯片与离子阱质谱连接的装置(示意图见图11-28(a))[27],利用该装置实现了牛胰核糖核酸酶B(RNase B)的胰蛋白酶水解产物的芯片电泳分离和离子阱质谱检测。图11-28(b)是得到的RNase B的胰蛋白酶水解产物的总离子流图、总离子质谱图(图11-28(c))以及部分水解产物的单离子流图(图11-28(d))。通过对谱图的分析,可以确定RNase B中含有五种高甘露糖型的糖链,也可以看出肽和糖肽可以实现芯片电泳的完全分离。
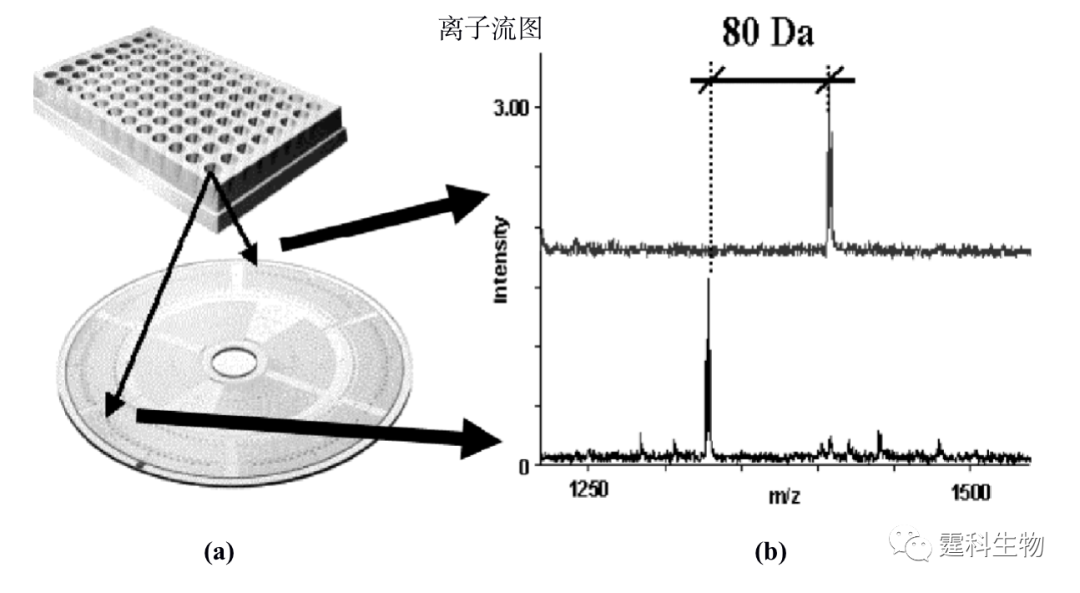
图11-28 微流控芯片/质谱联用装置及其应用[27] (a) 芯片/质谱联用装置示意图;(b) 牛胰核糖核酸酶 B的胰蛋白酶水解产物经芯片电泳/质谱分离检测得到的总离子流图和(c)质谱图及(d) 部分肽或者糖肽的单离子流图 11.2.3.2 蛋白质的磷酸化 蛋白质磷酸化是细胞内信息传递的重要调控机制,若此机制功能丧失,将导致细胞生长及分化异常,进而引起生物体病变。在哺乳动物体内的蛋白质大约有三分之一被认为是磷酸化修饰的,对众多生物化学功能起开关调控作用。因此,对蛋白质磷酸化的分析是蛋白质组研究的一个重要方面。 蛋白质磷酸化分析包括两个方面:磷酸化位点的确定和其所连接的磷酸化肽段的分析。目前用于蛋白质磷酸化分析常用的方法是固相金属亲和色谱(IMAC)/质谱。该方法适用于微量复杂样品的处理,为磷酸化蛋白的研究提供了便利条件。已有研究组尝试用微流控芯片上的IMAC进行蛋白质磷酸化的分析。如图11-29(a)是一种集成有固相金属亲和色谱和MALDI/MS检测样品盘的CD状芯片[28],该芯片可用于蛋白质的磷酸化分析。磷酸化蛋白经过胰蛋白酶酶切之后,经CD状芯片上纳升级的固相金属亲和色谱将带有磷酸基团的肽段富集,通过去磷酸化将富集的肽段洗脱,最后经MALDI质谱检测,通过丢失磷酸基团而产生80 Da(或其倍数)的质量位移来鉴定磷酸化肽段(图11-29 (b)),使用该方法对人体内的盐皮质激素受体的磷酸化进行分析,在该蛋白质的配基结合区发现了两个新的磷酸化位点Thr 735和Ser 737。
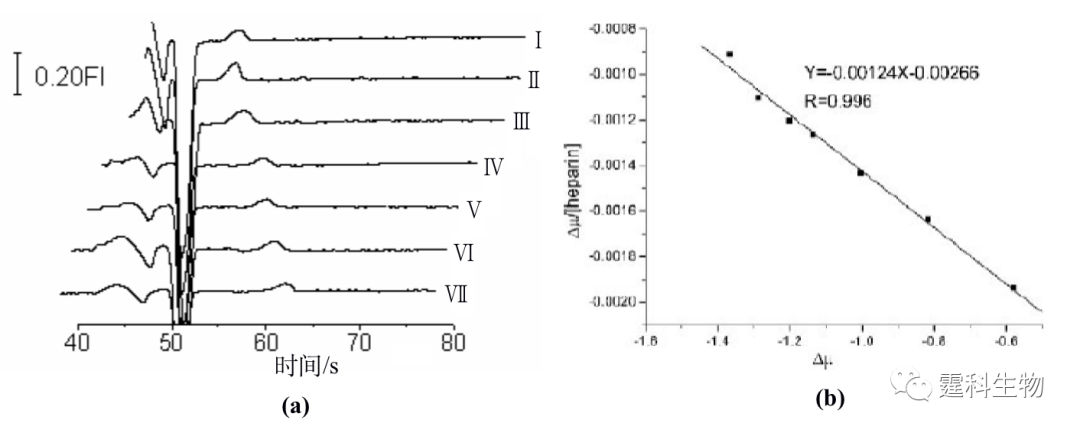
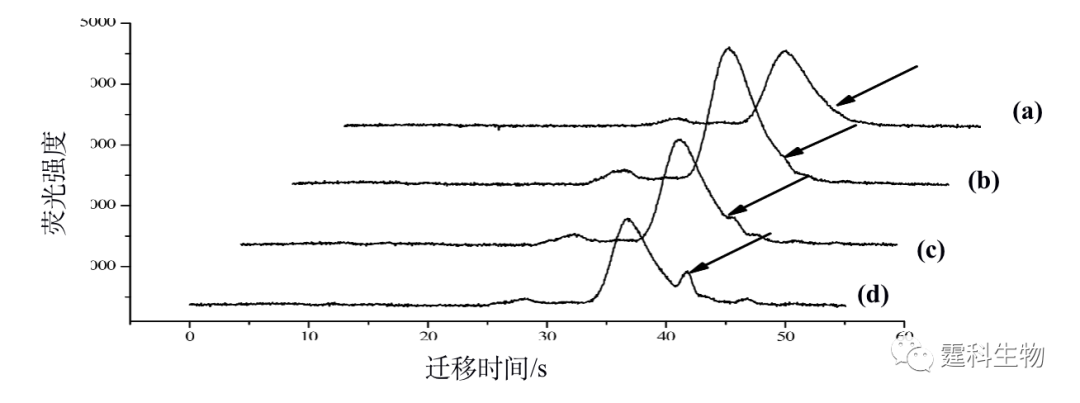
图11-29 固相金属亲和色谱/MALDI/MS 联用芯片及其应用[28] (a) 检测样品盘中CD状芯片示意图;(b) 磷酸化蛋白质谱图 11.2.3.3 蛋白质分子参与的相互作用 分子相互作用具有专一性并且广泛存在于生物体内,生物分子参与的相互作用和许多生命活动的基本单元紧密相关,是生命过程的基础。定性、定量表征分子相互作用有助于深刻理解生命过程的本质,尤其是蛋白质分子参与的相互作用在一定程度上决定了体内相当多的物质的生理活性和代谢过程。例如,激素和药物只有同靶蛋白结合后,才能发挥它们的生理活性;通过与血清蛋白的吸附或者结合,药物才能够运输到身体各部位进而产生疗效。研究蛋白质分子参与的相互作用在基础生物化学、药物发现和发展、临床诊断中都具有极其重要的意义。微流控芯片在分子相互作用方面的研究刚刚展开,已经显示出了其它单一方法无可比拟的优势,如快速、消耗少、高通量分析、操作模式多和能够集成多种操作单元等。 作者所在课题组以肝素为模型药物,在单通道玻璃微流控芯片上,以亲和电泳模式研究了肝素和人血清白蛋白的相互作用[29],根据运行缓冲液中配体浓度和受体淌度变化的关系,计算得到受体和配体间相互作用的结合常数。图11-30(a)是采用间接激光诱导荧光检测测定的肝素和血清蛋白分子相互作用的电泳图,图11-30(b)是相互作用的结合常数曲线,采用间接激光诱导荧光检测可以避免由荧光标记大分子引起的其结合位点的可能扰动。
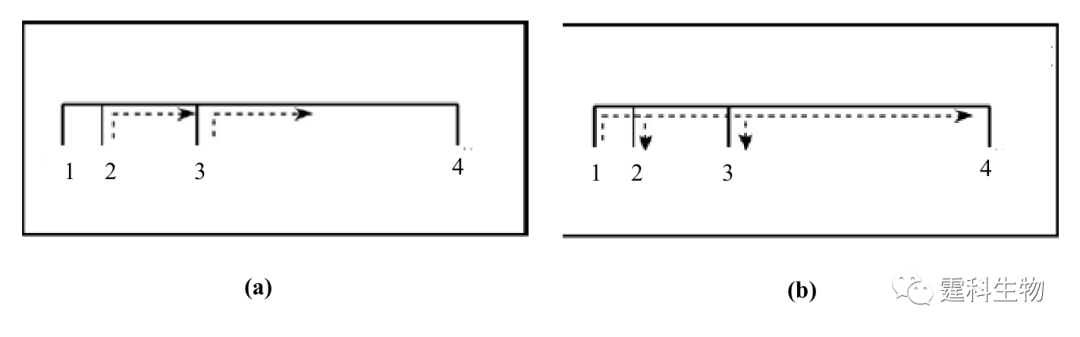
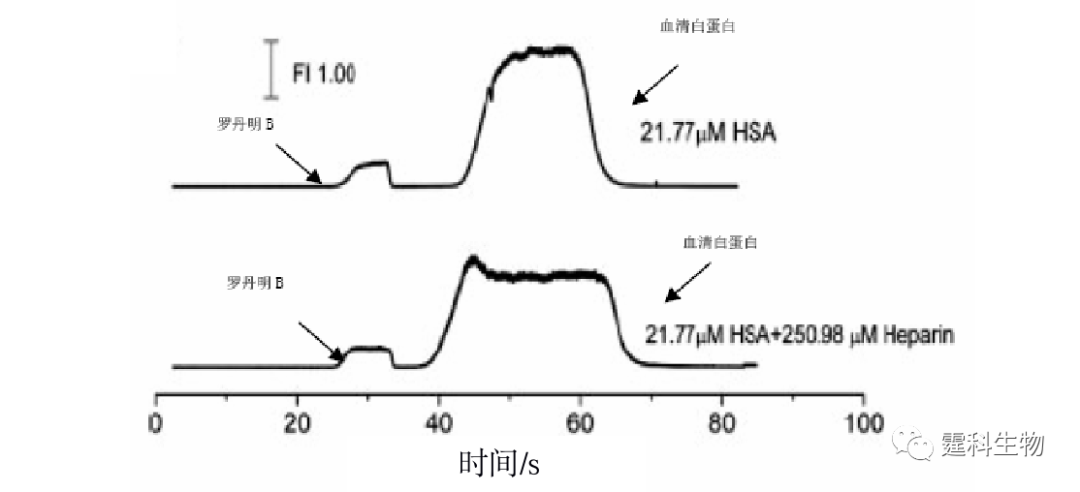
图11-30 微流控芯片血清蛋白亲和电泳[29] (a) 血清白蛋白的亲和电泳谱图;(b) 肝素和血清蛋白相互作用的结合常数曲线 (a) 图中运行缓冲液中含有不同浓度的肝素(Ⅰ) 0 μM;(Ⅱ) 300 μM;(Ⅲ) 500 μM;(Ⅳ)700 μM;(Ⅵ) 900 μM;(Ⅴ) 1000 μM;(Ⅶ) 1167 μM 在此基础上,作者实验室又将毛细管电泳中用于研究分子间相互作用的前沿分析模式转移到了微流控芯片上[30],设计了一块双进样通道微流控芯片,采用前沿分析模式进行了血清白蛋白和肝素相互作用的研究。分析过程如图11-31所示,进样时,通过加在池子上的电压控制样品流向,使两个样品独立地同时进入到分离通道的不同部位(图11-31(a)),分离时,后面的样品因其迁移速度慢而追不上前面的样品(图11-31(b))。图11-32所示为以芯片电泳前沿分析模式来研究肝素和血清蛋白相互作用的电泳谱图。随着混合物中肝素浓度增加,血清白蛋白的峰逐渐变低变宽。游离血清白蛋白的迁移速度比游离肝素和血清白蛋白-肝素结合物都大,会逐渐迁移出样品区带。为维持样品区带中的平衡,血清白蛋白-肝素结合物会逐渐解离,直至消失。这一过程引起血清白蛋白峰展宽变低,而面积不变。
图11-31 双进样通道微流控芯片用于蛋白质相互作用研究[30] (a) 进样和 (b)分离过程示意图 1和4池中为缓冲液, 2和3为样品池,样品的迁移速度2小于3;箭头所指为溶液的移动方向
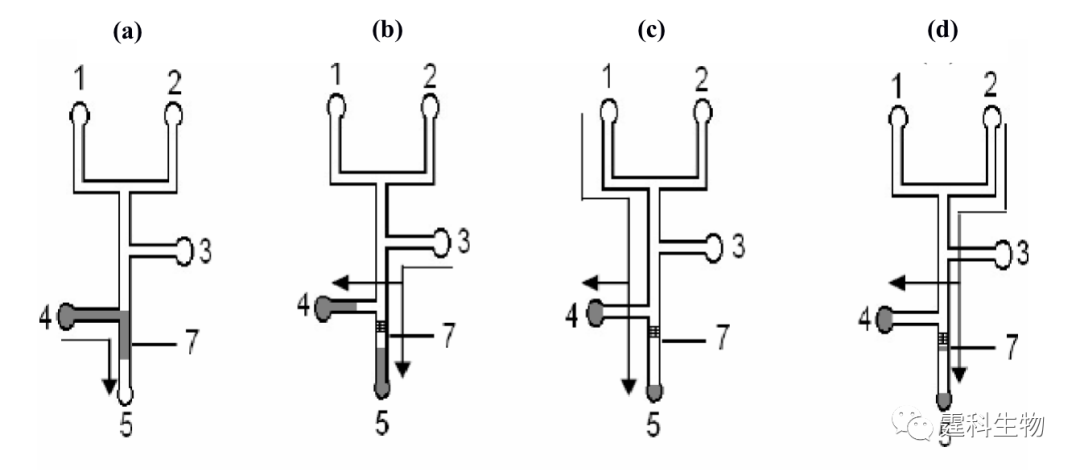
图11-32 芯片电泳前沿分析研究肝素和血清蛋白相互作用的电泳谱图[30] 此后,作者实验室又设计了一块集成亲和色谱微流控芯片,用于粒细胞集落刺激因子和硫酸多糖(G-CSF)相互作用的研究[31]。在微流控芯片通道内制备了600 μm长的亲和整体柱,亲和色谱芯片的整个操作过程如图11-33所示。首先,粒细胞集落刺激因子在电渗流驱动下,持续流过肝素亲和柱。粒细胞集落刺激因子同固定肝素发生反应而被吸附,直至亲和柱饱和。而后用磷酸缓冲液冲洗饱和亲和柱,除去非特性吸附的靶蛋白直至基线平稳光滑。最后,用等梯度硫酸多糖溶液进行特异性洗脱,测出其洗脱浓度。利用硫酸多糖的洗脱浓度和其与G-CSF结合常数的线性关系,表征G-CSF参与的相互作用体系。
图11-33 集成整体柱亲和色谱芯片蛋白质相互作用研究的操作过程示意图[31] (a) 进样;(b)洗涤;(c) 低浓度洗脱;(d) 高浓度洗脱 1池中为高浓度洗脱液,2池中为高浓度洗脱液,3为辅助通道,4池中为样品,5池为废液池,7为整体柱,上面固定了肝素.箭头指示当电压加在通道末端储液池时溶液流动方向 迄今为止,微流控芯片上相互作用的研究,大体还停留在毛细管电泳方法转移的层次上,而微流控芯片多种操作单元灵活性结合,规模集成的特点还没有得到很好体现。仅有个别研究小组开始做些微尝试。作者所在课题组在四通道玻璃微流控芯片上研究了胰蛋白酶和胰蛋白酶抑制剂间的相互作用(图11-34)[32],在50 s内同时完成4个样品所含组分相互作用程度的测验,即每个样品平均耗时12.5 s。从图中可以看出,当胰蛋白酶与抑制剂浓度比为0.5时(图11-34 (b)),就能够监测到产物峰的出现。
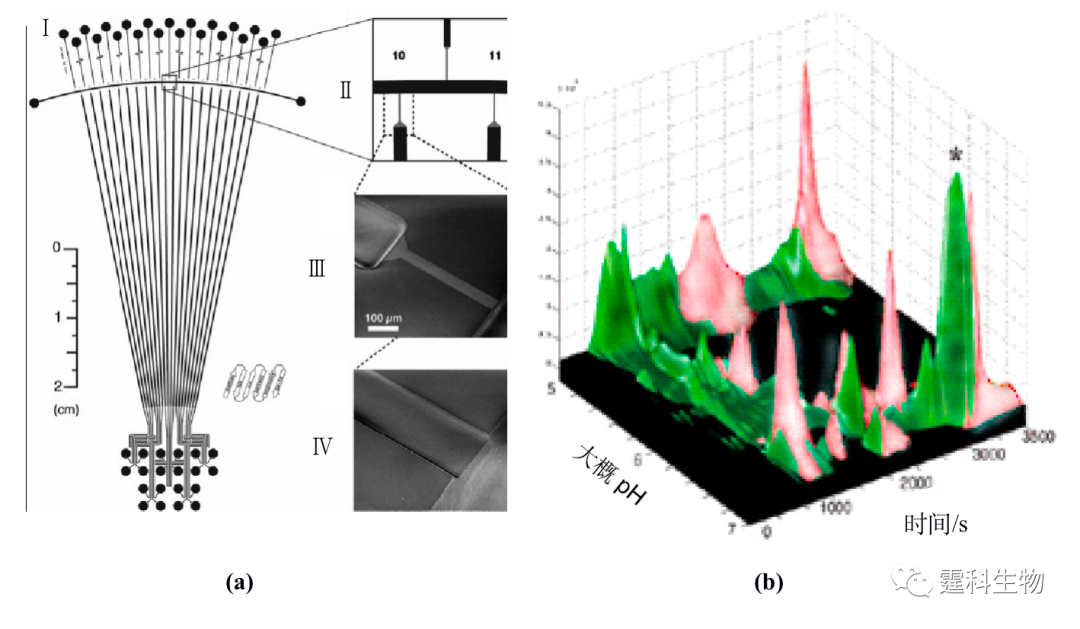
图11-34 四通道胰蛋白酶和胰蛋白酶抑制剂相互作用电泳图[32] 胰蛋白酶与抑制剂浓度比(a) 0;(b) 0.5;(c) 1.0;(d) 2.0 11.2.4 蛋白质实际样品分析 11.2.4.1 细胞内蛋白质表达研究 由于外界刺激或者环境的改变,细胞在蛋白的表达上会出现差异。要精确的了解这些变化,需要定量的测定细胞内蛋白含量在刺激前后的差异。微流控芯片上的多维分离技术为测定这些差异提供了有利的条件。图11-35显示,可以在玻璃芯片上实现等电聚焦与凝胶电泳联用测定大肠杆菌在异丙基-β-D-硫代半乳糖苷(IPTG)的刺激下,麦芽糖结合蛋白表达的差异[33]。图11-35(a)为所用二维电泳微流控芯片结构示意图和局部放大图,等电聚焦在3.75 cm长的弧形通道内完成,凝胶电泳在6.8 cm长的20根平行通道内完成,其中,放大图(B,C,和D对应的图)表示二维通道连接处采用较窄的通道连接,这样就避免了两维之间样品的相互泄漏。图11-35(b)表示大肠杆菌在IPTG刺激前后蛋白表达的二维电泳图,图中深色谱峰对应的是经过IPTG刺激后大肠杆菌表达的麦芽糖结合蛋白,浅色谱峰对应的是没有经过IPTG刺激的大肠杆菌表达的麦芽糖结合蛋白。可以看出,大肠杆菌经IPTG刺激前后,其中的麦芽糖结合蛋白的表达存在显著的差异。
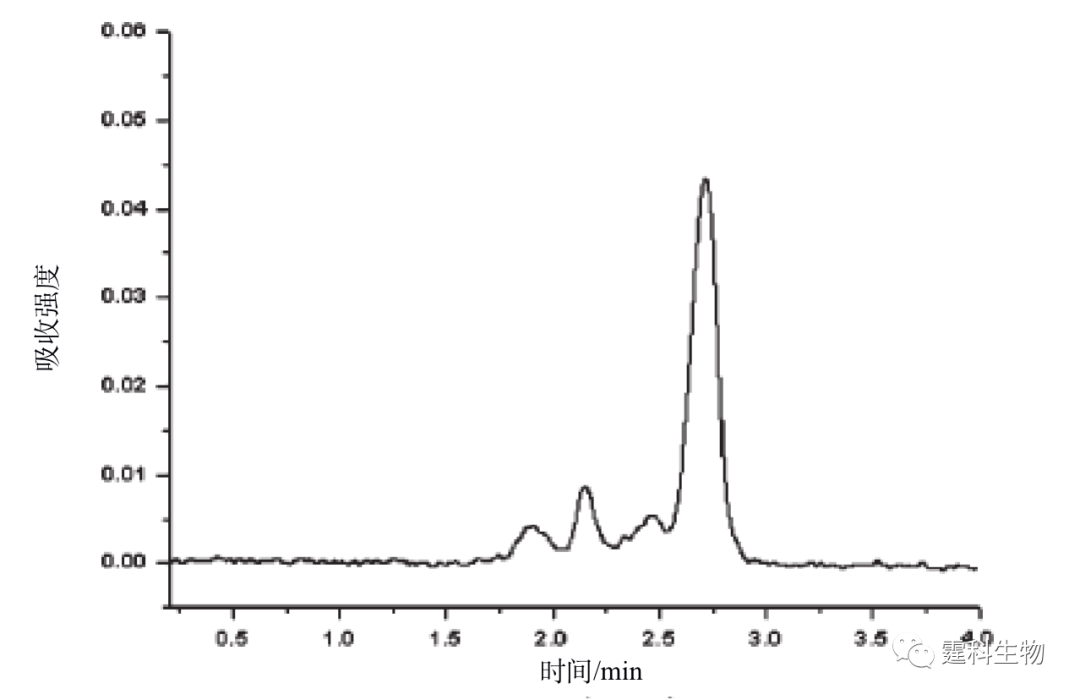
图11-35 蛋白表达分析二维电泳微流控芯片[33] (a) 芯片结构示意图和局部放大图;(b) IPTG诱导后大肠杆菌麦芽糖结合蛋白表达差异的二维电泳立体图 11.2.4.2 临床蛋白质样品分析 临床分析主要是指对血液、体液、尿液及其他排泄物和分泌物的检测分析,临床样品量一般都很少,同时要求检测周期短,微流控芯片快速、高效、高灵敏度的特点在临床分析中具有很大的应用前景尽管目前更多的还处于研究阶段。尿蛋白是诊断肾脏疾病和糖尿病的重要常规指标之一,张志泉等[34]在自制的十字架石英微流控芯片上,采用紫外吸收检测快速分离的尿蛋白。芯片电泳缓冲液为75 mmol/L pH 10.3 硼酸盐缓冲液内含9.73 μmol/L 乳酸钙、1% (v/v)乙胺,分离尿蛋白的谱图如图11-36所示。
图11-36 尿蛋白芯片电泳分离谱图[34] 参考文献  文章来源:《图解微流控芯片实验室》林炳承、秦建华 著 为进一步推广普及微流控芯片技术,霆科生物获得林炳承先生授权,公司网站及公众号开辟“图解微流控”专版,连载《图解微流控芯片实验室》一书的主要内容。 本版刊登内容仅限于学术交流,严禁用于任何商业用途。 欢迎转发分享,如需转载请与我们联系,谢谢! |